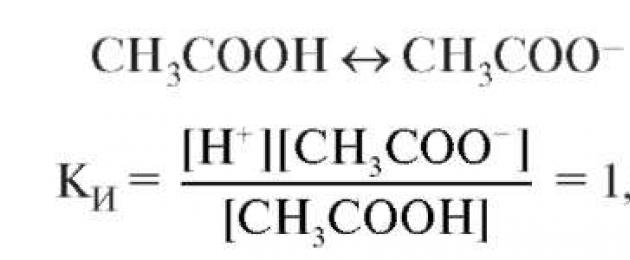Ορισμός.
Στην εργαστηριακή πρακτική, είναι συχνά απαραίτητο να εργαστείτε με διαλύματα που έχουν μια συγκεκριμένη τιμή pH. Τέτοια διαλύματα ονομάζονται ρυθμιστικά διαλύματα.
Ρυθμιστικά διαλύματα– διαλύματα των οποίων το pH παραμένει ουσιαστικά αμετάβλητο όταν προστίθενται μικρές ποσότητες οξέων και βάσεων σε αυτά ή όταν αραιώνονται.
Τα ρυθμιστικά διαλύματα μπορούν να είναι τεσσάρων τύπων:
1. Ασθενές οξύ και το άλας του.Για παράδειγμα, ρυθμιστικό διάλυμα οξικού CH 3 COOH + CH 3 COONa (pH = 4,7).
2. Αδύναμη βάση και το αλάτι της.Για παράδειγμα, ένα ρυθμιστικό διάλυμα αμμωνίας NH 4 OH + NH 4 Cl (pH = 9,2).
3. Διάλυμα δύο αλάτων οξέος.Για παράδειγμα, ρυθμιστικό διάλυμα φωσφορικών NaH 2 PO 4 + Na 2 HPO 4 (pH=8). Σε αυτή την περίπτωση, το αλάτι παίζει το ρόλο ενός ασθενούς οξέος.
Ρυθμιστικά διαλύματα αμινοξέων και πρωτεϊνών.
Μηχανισμός δράσης.
Η δράση των ρυθμιστικών διαλυμάτων βασίζεται στο γεγονός ότι τα ρυθμιστικά ιόντα ή μόρια δεσμεύουν ιόντα Η + ή ΟΗ - οξέων ή αλκαλίων που εισάγονται σε αυτά για να σχηματίσουν ασθενείς ηλεκτρολύτες. Για παράδειγμα, εάν προστεθεί υδροχλωρικό οξύ σε οξικό ρυθμιστικό διάλυμα CH 3 COOH + CH 3 COONa, η αντίδραση θα συμβεί:
CH 3 COONa + HCl = CH 3 COOH + NaCl
CH 3 COO - + H + = CH 3 COOH
Τα ιόντα CH 3 COO - που αλληλεπιδρούν με κατιόντα H + υδροχλωρικού οξέος, σχηματίζουν μόρια οξικού οξέος· το H + δεν συσσωρεύεται στο διάλυμα, επομένως η συγκέντρωσή τους πρακτικά δεν αλλάζει και επομένως η τιμή του pH του διαλύματος δεν αλλάζει.
Όταν ένα αλκάλιο (για παράδειγμα, NaOH) προστίθεται σε ένα ρυθμιστικό διάλυμα οξικού, εμφανίζεται η ακόλουθη αντίδραση:
CH 3 COOH + NaOH = CH 3 COONa + H 2 O
CH 3 COOH + OH - = CH 3 COO - + H 2 O
Τα κατιόντα H + οξικού οξέος συνδυάζονται με ιόντα ΟΗ - αλκαλίων για να σχηματίσουν νερό. Η συγκέντρωση του οξέος μειώνεται. Αντί για τα χρησιμοποιημένα κατιόντα H +, ως αποτέλεσμα της διάστασης του οξικού οξέος CH 3 COOH, επανεμφανίζονται κατιόντα H + και αποκαθίσταται η προηγούμενη συγκέντρωσή τους και η τιμή του pH του διαλύματος δεν αλλάζει.
Χωρητικότητα buffer.
Οποιοδήποτε ρυθμιστικό διάλυμα διατηρεί πρακτικά σταθερό pH μόνο μέχρις ότου προστεθεί μια ορισμένη ποσότητα οξέος ή αλκαλίου, δηλαδή έχει μια ορισμένη χωρητικότητα buffer.
χωρητικότητα buffer -Αυτή είναι η οριακή ποσότητα (mol) ενός ισχυρού οξέος ή αλκαλίου που μπορεί να προστεθεί σε 1 λίτρο ρυθμιστικού διαλύματος έτσι ώστε το pH του να μην αλλάξει περισσότερο από ένα.
Παρασκευή.
Οι ιδιότητες του ρυθμιστικού διαλύματος είναι πολύ αδύναμες εάν η συγκέντρωση ενός συστατικού είναι 10 φορές ή περισσότερο διαφορετική από τη συγκέντρωση του άλλου. Ως εκ τούτου, τα ρυθμιστικά διαλύματα συχνά παρασκευάζονται με ανάμιξη διαλυμάτων ίσων συγκεντρώσεων και των δύο συστατικών ή με προσθήκη σε ένα διάλυμα ενός συστατικού της κατάλληλης ποσότητας αντιδραστηρίου, οδηγώντας στον σχηματισμό ίσης συγκέντρωσης της συζυγούς μορφής.
Για να παρασκευαστεί ένα μίγμα ρυθμιστικού διαλύματος αμμωνίας, αναμείξτε 100 ml διαλύματος NH 4 Cl με κλάσμα μάζας 10% και 100 ml διαλύματος NH 4 OH με κλάσμα μάζας 10% και αραιώστε το προκύπτον μείγμα με απεσταγμένο νερό σε 1 λίτρο.
Εφαρμογή.
Τα ρυθμιστικά διαλύματα χρησιμοποιούνται ευρέως στη χημική ανάλυση και στη βιοχημική ανάλυση για τη δημιουργία και τη διατήρηση μιας ορισμένης τιμής pH του μέσου κατά τη διάρκεια των αντιδράσεων.
Για παράδειγμα, τα ιόντα Ba2+ διαχωρίζονται από τα ιόντα Ca2+ με καθίζηση με διχρωμικά ιόντα Cr 2 O 7 2- παρουσία οξικού ρυθμιστικού διαλύματος. Κατά τον προσδιορισμό πολλών κατιόντων μετάλλων χρησιμοποιώντας Trilon B με σύνθετη μέτρηση, χρησιμοποιείται ένα ρυθμιστικό διάλυμα αμμωνίας.
Τα ρυθμιστικά διαλύματα εξασφαλίζουν τη σταθερότητα των βιολογικών υγρών και ιστών. Τα κύρια ρυθμιστικά συστήματα στο σώμα είναι τα υδρογονανθρακικά, η αιμοσφαιρίνη, τα φωσφορικά άλατα και οι πρωτεΐνες. Επιπλέον, η δράση όλων των buffer συστημάτων είναι διασυνδεδεμένη. Τα ιόντα υδρογόνου που προέρχονται από το εξωτερικό ή σχηματίζονται κατά τη διάρκεια της μεταβολικής διαδικασίας δεσμεύονται από ένα από τα συστατικά των ρυθμιστικών συστημάτων. Ωστόσο, σε ορισμένες ασθένειες, μπορεί να συμβεί αλλαγή στην τιμή του pH του αίματος. Ονομάζεται μετατόπιση της τιμής του pH του αίματος στην όξινη περιοχή από την κανονική τιμή pH του 7,4 αλκαλική ύφεσις αίματος, στην αλκαλική περιοχή – αλκάλωση.Η οξέωση εμφανίζεται σε σοβαρές μορφές σακχαρώδη διαβήτη, παρατεταμένη σωματική εργασία και φλεγμονώδεις διεργασίες. Αλκάλωση μπορεί να εμφανιστεί σε περιπτώσεις σοβαρής νεφρικής ή ηπατικής ανεπάρκειας ή αναπνευστικής ανεπάρκειας.
Βιολογικά υγρά, ιστοί και όργανα.
Αυτό εκφράζεται σε αρκετά σταθερές τιμές pH των βιολογικών μέσων (αίμα, σάλιο, γαστρικό υγρό κ.λπ.) και την ικανότητα του σώματος να αποκαθιστά τις φυσιολογικές τιμές pH όταν εκτίθεται σε πρωτόλιθους. Υποστήριξη συστήματος πρωτολυτική ομοιόσταση,περιλαμβάνει όχι μόνο φυσιολογικούς μηχανισμούς (πνευμονική και νεφρική αντιστάθμιση), αλλά και φυσικοχημικούς: ρυθμιστική δράση, ανταλλαγή ιόντων και διάχυση.
Η εξασφάλιση σταθερού pH του αίματος και άλλων οργάνων και ιστών είναι μια από τις σημαντικότερες προϋποθέσεις για την κανονική ύπαρξη του οργανισμού. Αυτή η διάταξη επιτυγχάνεται με την παρουσία πολυάριθμων ρυθμιστικών συστημάτων στο σώμα, τα σημαντικότερα από τα οποία είναι τα ρυθμιστικά συστήματα. Τα τελευταία παίζουν σημαντικό ρόλο στη διατήρηση του συμπλέγματος πυρήνα στο σώμα.
Επιπλέον, το υλικό για αυτό το θέμα είναι απαραίτητο για τη μελέτη μεταγενέστερων θεμάτων του θέματος (ποτενσιομετρία, ιδιότητες διαλυμάτων IUD, κ.λπ.) και κλάδους όπως βιοχημεία, μικροβιολογία, ιστολογία, υγιεινή, φυσιολογία, στις πρακτικές δραστηριότητες ενός γιατρού όταν αξιολόγηση του τύπου και της σοβαρότητας των διαταραχών COR.
Ρυθμιστικά διαλύματαλέγονται διαλύματα που διατηρούν την ίδια τιμή pH όταν αραιώνονται ή προστίθενται με μικρή ποσότητα ισχυρού οξέος ή βάσης.Τα πρωτολυτικά ρυθμιστικά διαλύματα είναι μίγματα ηλεκτρολυτών που περιέχουν ιόντα με το ίδιο όνομα.
Υπάρχουν κυρίως δύο τύποι πρωτολυτικών ρυθμιστικών διαλυμάτων:
Όξινο δηλ. που αποτελείται από ένα ασθενές οξύ και μια περίσσεια της συζυγούς του βάσης (άλας που σχηματίζεται από μια ισχυρή βάση και ένα ανιόν αυτού του οξέος). Για παράδειγμα: CH 3 COOH και CH 3 COONa - ρυθμιστικό διάλυμα οξικού
CH 3 COOH + H 2 O ↔ H 3 O + + CH 3 COO - περίσσεια συζευγμένη
όξινη βάση
CH 3 COONa → Na + + CH 3 COO -
Τα βασικά, δηλ. που αποτελείται από μια ασθενή βάση και μια περίσσεια του συζευγμένου οξέος της (δηλαδή, ένα άλας που σχηματίζεται από ένα ισχυρό οξύ και ένα κατιόν αυτής της βάσης). Για παράδειγμα: NH 4 OH και NH 4 Cl - ρυθμιστικό διάλυμα αμμωνίας.
NH 3 + H 2 O ↔ OH - + NH 4 + περίσσεια συζυγούς
όξινη βάση
NH 4 Cl → Cl - + NH 4 +
Η εξίσωση του συστήματος προσωρινής αποθήκευσης υπολογίζεται χρησιμοποιώντας τον τύπο Henderson-Hasselbach:
pH = pK + log, pOH = pK + log,
όπου pK = -log K D.
C - μοριακή ή ισοδύναμη συγκέντρωση ηλεκτρολύτη (C = V N)
Μηχανισμός δράσης ρυθμιστικών διαλυμάτων
Ας το εξετάσουμε χρησιμοποιώντας το παράδειγμα του ρυθμιστικού διαλύματος οξικού: CH 3 COOH + CH 3 COONa
Η υψηλή συγκέντρωση οξικών ιόντων οφείλεται στην πλήρη διάσπαση του ισχυρού ηλεκτρολύτη - οξικό νάτριο, και το οξικό οξύ, παρουσία του ομώνυμου ανιόντος, υπάρχει σε διάλυμα σε σχεδόν μη ιονισμένη μορφή.
1. Όταν προστίθεται μικρή ποσότητα υδροχλωρικού οξέος, τα ιόντα Η+ συνδέονται με τη συζευγμένη βάση CH 3 COO - που υπάρχει στο διάλυμα στον ασθενή ηλεκτρολύτη CH 3 COOH.
CH 3 COO‾ +H + ↔ CH 3 COOH (1)
Από την εξίσωση (1) είναι σαφές ότι το ισχυρό οξύ HC1 αντικαθίσταται από μια ισοδύναμη ποσότητα του ασθενούς οξέος CH 3 COOH. Η ποσότητα του CH 3 COOH αυξάνεται και, σύμφωνα με το νόμο αραίωσης του W. Ostwald, ο βαθμός διάστασης μειώνεται. Ως αποτέλεσμα, η συγκέντρωση των ιόντων H + στο ρυθμιστικό αυξάνεται, αλλά πολύ ελαφρά. Το pH παραμένει σταθερό.
Όταν προσθέτουμε ένα οξύ σε ένα ρυθμιστικό διάλυμα, το pH προσδιορίζεται από τον τύπο:
pH = pK + log
2. Όταν προστίθεται μικρή ποσότητα αλκαλίου στο ρυθμιστικό, αυτό αντιδρά με CH 3 COOH. Τα μόρια του οξικού οξέος θα αντιδράσουν με ιόντα υδροξειδίου για να σχηματίσουν H 2 O και CH 3 COO ‾:
CH 3 COOH + OH ‾ ↔ CH 3 COO‾ + H 2 O (2)
Ως αποτέλεσμα, το αλκάλι αντικαθίσταται από μια ισοδύναμη ποσότητα του ασθενώς βασικού άλατος CH 3 COONa. Η ποσότητα του CH 3 COOH μειώνεται και, σύμφωνα με τον νόμο αραίωσης του W. Ostwald, ο βαθμός διάστασης αυξάνεται λόγω της πιθανής οξύτητας των εναπομεινάντων αδιάσπαστων μορίων CH 3 COOH. Κατά συνέπεια, η συγκέντρωση των ιόντων Η+ παραμένει ουσιαστικά αμετάβλητη. Το pH παραμένει σταθερό.
Κατά την προσθήκη αλκαλίων, το pH προσδιορίζεται από τον τύπο:
pH = pK + log
3. Κατά την αραίωση του ρυθμιστικού, το pH επίσης δεν αλλάζει, γιατί η σταθερά διάστασης και η αναλογία των συστατικών παραμένουν αμετάβλητα.
Έτσι, το pH του ρυθμιστικού εξαρτάται από: σταθερές διάστασης και αναλογίες συγκέντρωσης συστατικών. Όσο υψηλότερες είναι αυτές οι τιμές, τόσο υψηλότερο είναι το pH του ρυθμιστικού διαλύματος. Το pH του ρυθμιστικού διαλύματος θα είναι μεγαλύτερο όταν η αναλογία συστατικών είναι ίση με ένα.
Για τον ποσοτικό χαρακτηρισμό του buffer, εισάγεται η έννοια χωρητικότητα buffer.
ΕΙΣΑΓΩΓΗ
ΡΥΘΜΙΣΤΙΚΑ ΔΙΑΛΥΜΑΤΑ (ρυθμιστικά μίγματα, ρυθμιστικά διαλύματα) - διαλύματα που περιέχουν ρυθμιστικά συστήματα και, ως εκ τούτου, έχουν την ικανότητα να διατηρούν το pH σε σταθερό επίπεδο. Συνήθως παρασκευάζονται διαλύοντας ένα ασθενές οξύ και το άλας αλκαλιμετάλλου του που λαμβάνεται σε κατάλληλες αναλογίες σε νερό, εξουδετερώνοντας εν μέρει ένα ασθενές οξύ με ένα ισχυρό αλκάλιο ή μια ασθενή βάση με ένα ισχυρό οξύ και διαλύοντας ένα μείγμα αλάτων ενός πολυβασικού οξέος. Η τιμή του pH των ρυθμιστικών διαλυμάτων που παρασκευάζονται με αυτόν τον τρόπο ποικίλλει ελαφρώς ανάλογα με τη θερμοκρασία. Το εύρος τιμών pH στο οποίο ένα ρυθμιστικό διάλυμα έχει σταθερές ρυθμιστικές ιδιότητες βρίσκεται εντός pK ± 1 (το pK είναι ο αρνητικός δεκαδικός λογάριθμος της σταθεράς διάστασης του ασθενούς οξέος που περιλαμβάνεται στη σύνθεσή του). Τα πιο γνωστά ρυθμιστικά διαλύματα είναι: γλυκίνη Serensen, οξικό Walpole, φωσφορικό Serensen, βορικό Palich, veronal Michaelis, ανθρακικό Colthoff, ρυθμιστικό Tris, universal veronal Michaelis κ.λπ.
Στην εργαστηριακή πρακτική, ρυθμιστικά διαλύματα χρησιμοποιούνται για τη διατήρηση της ενεργού αντίδρασης του μέσου σε ένα συγκεκριμένο σταθερό επίπεδο και για τον προσδιορισμό της τιμής του pH - ως πρότυπα διαλύματα με σταθερές τιμές pH κ.λπ.
ΡΥΘΜΙΣΤΙΚΑ ΜΙΓΜΑΤΑ
Εάν προστεθεί νερό σε διάλυμα οποιουδήποτε οξέος ή αλκαλίου, τότε, φυσικά, η συγκέντρωση ιόντων υδρογόνου ή υδροξυλίου μειώνεται ανάλογα. Αλλά εάν προσθέσετε μια ορισμένη ποσότητα νερού σε ένα μείγμα οξικού οξέος και οξικού νατρίου ή σε ένα μείγμα υδροξειδίου του αμμωνίου και χλωριούχου αμμωνίου, η συγκέντρωση ιόντων υδρογόνου και υδροξυλίου σε αυτά τα διαλύματα δεν θα αλλάξει.
Η ικανότητα ορισμένων διαλυμάτων να διατηρούν σταθερή συγκέντρωση ιόντων υδρογόνου όταν αραιώνονται, καθώς και όταν προστίθενται μικρές ποσότητες ισχυρών οξέων ή αλκαλίων, είναι γνωστή ως ρυθμιστική δράση.
Τα διαλύματα που περιέχουν ταυτόχρονα ένα ασθενές οξύ και το άλας του ή μια ασθενή βάση και το άλας του και έχουν ρυθμιστικό αποτέλεσμα ονομάζονται ρυθμιστικά διαλύματα. Τα ρυθμιστικά διαλύματα μπορούν να θεωρηθούν ως μίγματα ηλεκτρολυτών που έχουν τα ίδια ιόντα. Η παρουσία ενός ασθενούς οξέος ή ασθενούς βάσης και των αλάτων τους σε ένα διάλυμα μειώνει την επίδραση της αραίωσης ή τη δράση άλλων οξέων και βάσεων στο pH του διαλύματος.
Τέτοια ρυθμιστικά διαλύματα είναι τα ακόλουθα μίγματα CH 3 COOH + CH 3 C OON a, NH 4 OH + NH 4 Cl, Na 2 CO 3 + NaHCO 3, κ.λπ.
Τα ρυθμιστικά διαλύματα, τα οποία είναι μείγματα ασθενών οξέων και των αλάτων τους, έχουν συνήθως όξινη αντίδραση (pH<7). Например, буферная смесь 0,1М раствора СН 3 COOP + 0,1 M διάλυμα CHΤο 3 CO ONa έχει pH = 4,7.
Τα ρυθμιστικά διαλύματα, που είναι μίγματα ασθενών βάσεων και των αλάτων τους, έχουν συνήθως αλκαλική αντίδραση (pH>7). Για παράδειγμα, ένα ρυθμιστικό μίγμα διαλύματος 0,1 ΜΤο διάλυμα N H 4 OH + 0,1 M N H 4 C1 έχει pH = 9,3.
Οξεοβασικά ρυθμιστικά διαλύματα
Με μια ευρεία έννοια, τα buffer συστήματα είναι συστήματα που διατηρούν μια ορισμένη τιμή μιας παραμέτρου όταν αλλάζει η σύνθεση. Τα ρυθμιστικά διαλύματα μπορούν να είναι
όξινη βάση - διατηρήστε μια σταθερή τιμή pH προσθέτοντας μικρές ποσότητες οξέος ή βάσης.
Το Redox διατηρεί σταθερό το δυναμικό του συστήματος όταν εισάγονται οξειδωτικοί ή αναγωγικοί παράγοντες.
Είναι γνωστά ρυθμιστικά διαλύματα μετάλλων που διατηρούν σταθερή τιμή pH.
Σε όλες τις περιπτώσεις, το ρυθμιστικό διάλυμα είναι ένα συζυγές ζεύγος. Συγκεκριμένα, τα ρυθμιστικά διαλύματα οξέος-βάσης περιέχουν ένα συζευγμένο ζεύγος οξέος-βάσης. Το ρυθμιστικό αποτέλεσμα αυτών των διαλυμάτων οφείλεται στην παρουσία μιας γενικής οξεοβασικής ισορροπίας:
NA ↔ N + + A -
συζευγμένο οξύ
Βάση
B + N + ↔ VN +
ΣΧΕΤΙΚΑ ΜΕ στημόνι συζυγής
Οξύ
Δεδομένου ότι αυτή η ενότητα εξετάζει μόνο ρυθμιστικά διαλύματα οξέος-βάσης, θα τα ονομάσουμε ρυθμιστικά διαλύματα, παραλείποντας το "οξέος-βάσης" στο όνομα.
Τα ρυθμιστικά διαλύματα είναι διαλύματα που διατηρούν σταθερή τιμή pH με αραίωση και προσθήκη μικρών ποσοτήτων οξέος ή βάσης.
Ταξινόμηση ρυθμιστικών συστημάτων
1. μείγματα διαλυμάτων ασθενών οξέων και των αλάτων τους. Για παράδειγμα, ρυθμιστικό διάλυμα οξικού.
2. μείγματα διαλυμάτων ασθενών βάσεων και των αλάτων τους. Για παράδειγμα, ρυθμιστικό διάλυμα αμμωνίου.
3. μίγματα διαλυμάτων αλάτων πολυβασικών οξέων διαφόρων βαθμών υποκατάστασης. Για παράδειγμα, ρυθμιστικό διάλυμα φωσφορικών.
4. ιόντα και μόρια αμφολυτών. Αυτά περιλαμβάνουν, για παράδειγμα, αμινοξέα και πρωτεϊνικά ρυθμιστικά συστήματα. Όντας σε ισοηλεκτρική κατάσταση, τα αμινοξέα και οι πρωτεΐνες δεν είναι ρυθμιστικά διαλύματα. Το ρυθμιστικό αποτέλεσμα εμφανίζεται μόνο όταν προστίθεται σε αυτά μια ορισμένη ποσότητα οξέος ή αλκαλίου. Στην περίπτωση αυτή, σχηματίζεται ένα μείγμα δύο μορφών πρωτεΐνης: α) ένα ασθενές «πρωτεϊνικό οξύ» + ένα άλας αυτού του ασθενούς οξέος. β) αδύναμη «πρωτεϊνική βάση» + αλάτι αυτής της αδύναμης βάσης. Έτσι, αυτός ο τύπος ρυθμιστικών συστημάτων μπορεί να ταξινομηθεί ως buffer συστήματα πρώτου ή δεύτερου τύπου.
Υπολογισμός pH ρυθμιστικών διαλυμάτων
Η βάση για τον υπολογισμό του pH των ρυθμιστικών συστημάτων είναι ο νόμος της δράσης μάζας για την οξεοβασική ισορροπία. Για ένα ρυθμιστικό σύστημα που αποτελείται από ένα ασθενές οξύ και το άλας του, για παράδειγμα οξικό, η συγκέντρωση ιόντωνΗ+ εύκολο να υπολογιστεί με βάση τη σταθερά ισορροπίας του οξικού οξέος:
CH 3 COOH ↔ CH 3 COO - + H +
(1).
Από το (1) προκύπτει ότι η συγκέντρωση των ιόντων υδρογόνου είναι ίση με
(2)
Παρουσία CH3 COONa Η οξεοβασική ισορροπία του οξικού οξέος μετατοπίζεται προς τα αριστερά. Επομένως, η συγκέντρωση του αδιάσπαστου οξικού οξέος είναι σχεδόν ίση με τη συγκέντρωση του οξέος, δηλ. [SN 3 COOH] = όξινο
Κύρια πηγή οξικών ιόντων ισχυρού ηλεκτρολύτη CH3COONa:
CH 3 COONa → Na + + CH 3 COO - ,
Επομένως, μπορούμε να δεχθούμε ότι [ CH 3 COO - ] = από αλάτι . Λαμβάνοντας υπόψη τις παραδοχές που έγιναν, η εξίσωση (2) παίρνει τη μορφή:
Από αυτό λαμβάνουμε την εξίσωση Henderson-Hasselbach για ρυθμιστικά συστήματα που αποτελούνται από ένα ασθενές οξύ και το άλας του:
(3)
Για ένα ρυθμιστικό σύστημα που αποτελείται από μια ασθενή βάση και το άλας της, για παράδειγμα, αμμωνία, η συγκέντρωση ιόντων υδρογόνου στο διάλυμα μπορεί να υπολογιστεί με βάση τη σταθερά διάστασης της ασθενούς βάσης.
NH 3 × H 2 O = NH 4 OH ↔ NH 4 + + OH -
(4)
Ας εκφράσουμε τη συγκέντρωση των ιόντων OH- από το ιοντικό προϊόν του νερού
(5)
και αντικαταστήστε το σε (4).
(6)
Από το (6) προκύπτει ότι η συγκέντρωση των ιόντων υδρογόνου είναι ίση με
(7)
Παρουσία NH 4 Cl η οξεοβασική ισορροπία μετατοπίζεται προς τα αριστερά. Επομένως, η συγκέντρωση της αδιάσπαστης αμμωνίας είναι σχεδόν ίση με τη συγκέντρωση της αμμωνίας, δηλ. [ NH 4 OH ] = με βάση.
Κύρια πηγή ισχυρού ηλεκτρολύτη κατιόντων αμμωνίου NH4Cl:
NH 4 Cl → NH 4 + + Cl -,
Επομένως, μπορούμε να δεχθούμε ότι [ NH 4 + ] = από αλάτι . Λαμβάνοντας υπόψη τις παραδοχές που έγιναν, η εξίσωση (7) παίρνει τη μορφή:
(8)
Από αυτό λαμβάνουμε την εξίσωση Henderson-Hasselbach για ρυθμιστικά συστήματα που αποτελούνται από μια ασθενή βάση και το άλας της:
(9)
Με παρόμοιο τρόπο, μπορείτε να υπολογίσετε το pH ενός ρυθμιστικού συστήματος που αποτελείται από ένα μείγμα διαλυμάτων αλάτων πολυβασικών οξέων διαφορετικών βαθμών υποκατάστασης, για παράδειγμα, φωσφορικό, που αποτελείται από ένα μείγμα διαλυμάτων όξινου φωσφορικού ( Na2HPO4 ) και διόξινο φωσφορικό ( NaH2PO4 ) νάτριο. Η δράση του βασίζεται στην οξεοβασική ισορροπία:
H 2 PO 4 - ↔ H + + HPO 4 2-
Ασθενής όξινη συζευγμένη βάση
(10)
Εκφράζοντας από το (10) τη συγκέντρωση ιόντων υδρογόνου και κάνοντας τις ακόλουθες παραδοχές:
[H2PO4-] = c (H2PO4-); [ HPO 4 2- ] = c (HPO 4 2- ), παίρνουμε:
(11).
Λαμβάνοντας τον λογάριθμο αυτής της έκφρασης και αντιστρέφοντας τα πρόσημα, λαμβάνουμε την εξίσωση Henderson-Hasselbach για τον υπολογισμό του pH του ρυθμιστικού συστήματος φωσφορικών
(12),
Όπου pK b (H 2 PO 4 - ) αρνητικός δεκαδικός λογάριθμος της σταθεράς διάστασης
φωσφορικό οξύ στο δεύτερο στάδιο. Με ( H 2 PO 4 - ) και με (HPO 4 2- ) αντίστοιχα, η συγκέντρωση οξέος και άλατος.
Ιδιότητες ρυθμιστικών διαλυμάτων
Η τιμή του pH των ρυθμιστικών διαλυμάτων παραμένει αμετάβλητη κατά την αραίωση, όπως προκύπτει από την εξίσωση Henderson-Hasselbalch. Όταν το ρυθμιστικό διάλυμα αραιώνεται με νερό, οι συγκεντρώσεις και των δύο συστατικών του μείγματος μειώνονται κατά τον ίδιο αριθμό φορών. Επομένως, η τιμή του pH δεν πρέπει να αλλάξει. Ωστόσο, η εμπειρία δείχνει ότι κάποια αλλαγή στο pH, αν και μικρή, συμβαίνει. Αυτό εξηγείται από το γεγονός ότι η εξίσωση Henderson-Hasselbalch είναι κατά προσέγγιση και δεν λαμβάνει υπόψη τις διαιονικές αλληλεπιδράσεις. Όταν γίνονται ακριβείς υπολογισμοί, θα πρέπει να λαμβάνεται υπόψη η αλλαγή στους συντελεστές δραστηριότητας του συζυγούς οξέος και βάσης.
Τα ρυθμιστικά διαλύματα αλλάζουν λίγο το pH όταν προστίθενται μικρές ποσότητες οξέος ή βάσης. Η ικανότητα των ρυθμιστικών διαλυμάτων να διατηρούν σταθερό pH όταν προστίθενται μικρές ποσότητες ισχυρού οξέος ή ισχυρής βάσης σε αυτά βασίζεται στο γεγονός ότι ένα συστατικό του ρυθμιστικού διαλύματος μπορεί να αντιδράσει με Η+ προστέθηκε οξύ και το άλλο με ΟΗ- προστέθηκε βάση. Ως αποτέλεσμα, το buffer σύστημα μπορεί να δεσμεύσει και τα δύο H + και OH - και διατηρεί σταθερή τιμή pH μέχρι ένα ορισμένο όριο. Ας το δείξουμε αυτό χρησιμοποιώντας το παράδειγμα ενός ρυθμιστικού συστήματος μυρμηκικού, το οποίο είναι ένα συζευγμένο ζεύγος οξέος-βάσης HCOOH/HCOO- . Η ισορροπία σε ένα ρυθμιστικό διάλυμα μυρμηκικού μπορεί να αναπαρασταθεί από την εξίσωση:
HCOOH ↔ HCOO - + H +
Όταν προστίθεται ένα ισχυρό οξύ, η συζευγμένη βάση HCOO- δεσμεύει τα προστιθέμενα ιόνταΗ+ , μετατρέπεται σε ασθενές μυρμηκικό οξύ:
HCOO - + H + ↔ HCOOH
Σύμφωνα με την αρχή του Le Chatelier, η ισορροπία μετατοπίζεται προς τα αριστερά.
Όταν προστίθεται αλκάλιο, τα πρωτόνια μυρμηκικού οξέος δεσμεύουν τα προστιθέμενα ιόντα ΟΗ- σε μόρια νερού:
HCOOH + OH - → HCOO - + H 2 O
Σύμφωνα με τον Le Chatelier, η οξεοβασική ισορροπία μετατοπίζεται προς τα δεξιά.
Και στις δύο περιπτώσεις υπάρχουν μικρές αλλαγές στην αναλογία HCOOH/HCOO- , αλλά ο λογάριθμος αυτής της αναλογίας αλλάζει ελάχιστα. Κατά συνέπεια, το pH του διαλύματος αλλάζει ελαφρώς.
Η ουσία της δράσης buffer
Η δράση των ρυθμιστικών διαλυμάτων βασίζεται στο γεγονός ότι τα μεμονωμένα συστατικά των ρυθμιστικών μειγμάτων δεσμεύουν ιόντα υδρογόνου ή υδροξυλίου των οξέων και βάσεων που εισάγονται σε αυτά για να σχηματίσουν ασθενείς ηλεκτρολύτες. Για παράδειγμα, εάν ένα ρυθμιστικό διάλυμα που περιέχει το ασθενές οξύ ΗΑ n και ένα άλας αυτού του οξέος Kt А n , προσθέστε αλκάλι, τότε θα συμβεί η αντίδραση του σχηματισμού ενός αδύναμου ηλεκτρολύτη-νερού:
H + + OH → H 2 O
Κατά συνέπεια, εάν προστεθεί ένα αλκάλιο σε ένα ρυθμιστικό διάλυμα που περιέχει ένα οξύ, τότε τα ιόντα υδρογόνου σχηματίζονται κατά την ηλεκτρολυτική διάσταση του οξέος ΗΑ n , δεσμεύονται στα ιόντα υδροξυλίου του προστιθέμενου αλκαλίου, σχηματίζοντας έναν ασθενή ηλεκτρολύτη-νερό. Αντί για κατανάλωση ιόντων υδρογόνου, λόγω της επακόλουθης διάστασης του οξέος ΗΑ n , εμφανίζονται νέα ιόντα υδρογόνου. Ως αποτέλεσμα, η προηγούμενη συγκέντρωση H+ - Τα ιόντα στο ρυθμιστικό διάλυμα θα αποκατασταθούν στην αρχική τους τιμή.
Εάν προστεθεί ένα ισχυρό οξύ στο καθορισμένο ρυθμιστικό μίγμα, η αντίδραση θα συμβεί:
N + + A n - → NA n
εκείνοι. A n - - ιόντα που σχηματίζονται κατά την ηλεκτρολυτική διάσταση του άλατος Κ t A n , σε συνδυασμό με ιόντα υδρογόνου του προστιθέμενου οξέος, σχηματίζουν μόρια ασθενούς οξέος. Επομένως, η συγκέντρωση των ιόντων υδρογόνου από την προσθήκη ενός ισχυρού οξέος στο ρυθμιστικό μίγμα πρακτικά δεν θα αλλάξει. Η επίδραση άλλων ρυθμιστικών μειγμάτων μπορεί να εξηγηθεί με παρόμοιο τρόπο.
Τιμή pH σε ρυθμιστικά διαλύματα
Αλλάζοντας τις αναλογίες μπορείτε να πάρετε buffer
διαλύματα που χαρακτηρίζονται από ομαλή μεταβολή του pH από τις ελάχιστες δυνατές τιμές τους. Σε υδατικό διάλυμα ασθενούς οξέος
[ H + ] = √K HAn * C HAn
που
pH = − log [ H + ] = − − log K HAn − − log C HAn
Αλλά αφού ο Κ ΧΑΝ είναι μια σταθερή τιμή, είναι καλύτερο να την αναπαραστήσετε στη μορφή pK HAn εκείνοι. δείκτης της σταθεράς ηλεκτρολυτικής διάστασης: pK Han = − log K HAn .
Τότε βρίσκουμε ότι σε υδατικό διάλυμα ασθενούς οξέος:
рН = − log [Н + ] = − − pK HAn − − pC HAn
Καθώς ένα άλας ασθενούς οξέος προστίθεται σε ένα υδατικό διάλυμα, το pH του διαλύματος θα αλλάξει.
Σύμφωνα με την εξίσωση, σε ένα διάλυμα που περιέχει ένα μείγμα ασθενούς οξέος και του άλατος του [Η+ ] = KHAn
Οτι
рН = − log [Н + ] = − log K HAn − log C HAn + log C Kt А n .
Εξάγουμε ομοίως τον τύπο για ασθενείς βάσεις:
[OH] = √K KtOH * C KtOH
pOH = − log [ OH ] = − − log K KtOH − − log C KtOH
Η συγκέντρωση ιόντων υδρογόνου εκφράζεται επίσης με τον ακόλουθο τύπο [Η+ ] = άρα
pH = pK w − (− pK KtOH − − log C KtOH )
Σύμφωνα με την εξίσωση, σε διάλυμα που περιέχει μείγμα ασθενούς βάσης και άλατος της
[Η+] =
Τ . μι.
pH = − log [ H + ] = − log K w + log K KtOH − logC Kt A n + log C KtOH.
Δεν χρειάζεται να απομνημονεύσετε τον παραγόμενο τύπο για τις τιμές του pH, καθώς προκύπτουν πολύ εύκολα λαμβάνοντας τον λογάριθμο απλών τύπων που εκφράζουν την τιμή του [H+ ].
Χωρητικότητα buffer
Η ικανότητα των ρυθμιστικών διαλυμάτων να διατηρούν σταθερή τιμή pH δεν είναι απεριόριστη και εξαρτάται από την ποιοτική σύνθεση του ρυθμιστικού διαλύματος και τη συγκέντρωση των συστατικών του. Όταν προστίθενται σημαντικές ποσότητες ισχυρού οξέος ή αλκαλίου σε ένα ρυθμιστικό διάλυμα, παρατηρείται αξιοσημείωτη αλλαγή στο pH. Επιπλέον, για διαφορετικά μίγματα ρυθμιστικού διαλύματος που διαφέρουν μεταξύ τους ως προς τη σύνθεση, που διαφέρουν μεταξύ τους στη σύνθεση, το ρυθμιστικό αποτέλεσμα δεν είναι το ίδιο. Κατά συνέπεια, τα ρυθμιστικά μίγματα μπορούν να διακριθούν από την ισχύ της αντίστασής τους στη δράση οξέων και αλκαλίων που εισάγονται στο ρυθμιστικό διάλυμα σε ίσες ποσότητες και μια ορισμένη συγκέντρωση. Η οριακή ποσότητα οξέος ή αλκαλίου ορισμένης συγκέντρωσης (σε mol/l ή g-eq/l) που μπορεί να προστεθεί σε ένα ρυθμιστικό διάλυμα έτσι ώστε η τιμή του pH του να μεταβάλλεται μόνο κατά μία μονάδα ονομάζεται ρυθμιστική ικανότητα.
Αν η τιμή [H + ] ενός ρυθμιστικού διαλύματος αλλάζει με την προσθήκη ισχυρού οξέος μικρότερου από την τιμή του [Η+ ] άλλου ρυθμιστικού διαλύματος όταν προσθέτουμε την ίδια ποσότητα οξέος, τότε το πρώτο μείγμα έχει μεγαλύτερη ρυθμιστική ικανότητα. Για το ίδιο ρυθμιστικό διάλυμα, όσο μεγαλύτερη είναι η συγκέντρωση των συστατικών του, τόσο μεγαλύτερη είναι η χωρητικότητα του ρυθμιστικού διαλύματος.
Ρυθμιστικές ιδιότητες διαλυμάτων ισχυρών οξέων και βάσεων.
Διαλύματα ισχυρών οξέων και βάσεων σε επαρκώς υψηλές συγκεντρώσεις έχουν επίσης ρυθμιστικό αποτέλεσμα. Τα συζευγμένα συστήματα σε αυτή την περίπτωση είναι H 3 O + /H 2 O για ισχυρά οξέα και ΟΗ- /H 2 O για γερές βάσεις. Ισχυρά οξέα και βάσεις διαχωρίζονται πλήρως σε υδατικά διαλύματα και επομένως χαρακτηρίζονται από υψηλή συγκέντρωση ιόντων υδρονίουή ιόντα υδροξυλίου. Επομένως, η προσθήκη μικρών ποσοτήτων ισχυρού οξέος ή ισχυρής βάσης στα διαλύματά τους έχει μικρή μόνο επίδραση στο pH του διαλύματος.
Παρασκευή ρυθμιστικών διαλυμάτων
1. Με αραίωση των κατάλληλων στερεωτικών σε ογκομετρική φιάλη.
2. Με ανάμειξη των ποσοτήτων των κατάλληλων συζυγών ζευγών οξέος-βάσης που υπολογίστηκαν χρησιμοποιώντας την εξίσωση Henderson-Hasselbach.
3. Μερική εξουδετέρωση ασθενούς οξέος με ισχυρό αλκάλιο ή ασθενούς βάσης με ισχυρό οξύ.
Δεδομένου ότι οι ρυθμιστικές ιδιότητες είναι πολύ αδύναμες εάν η συγκέντρωση ενός συστατικού είναι 10 φορές ή περισσότερο διαφορετική από τη συγκέντρωση του άλλου, τα ρυθμιστικά διαλύματα συχνά παρασκευάζονται με ανάμειξη διαλυμάτων ίσων συγκεντρώσεων και των δύο συστατικών ή με προσθήκη σε διάλυμα ενός συστατικού το κατάλληλο ποσότητα αντιδραστηρίου, που οδηγεί στο σχηματισμό ίσης συγκέντρωσης της συζυγούς μορφής. Η βιβλιογραφία αναφοράς περιέχει λεπτομερείς συνταγές για την παρασκευή ρυθμιστικών διαλυμάτων για διάφορες τιμές pH.
Εφαρμογή ρυθμιστικών διαλυμάτων στη χημική ανάλυση
Τα ρυθμιστικά διαλύματα χρησιμοποιούνται ευρέως στη χημική ανάλυση σε περιπτώσεις όπου, σύμφωνα με τις πειραματικές συνθήκες, πρέπει να συμβεί μια χημική αντίδραση διατηρώντας μια ακριβή τιμή pH που δεν αλλάζει όταν το διάλυμα αραιώνεται ή όταν προστίθενται άλλα αντιδραστήρια σε αυτό. Για παράδειγμα, κατά τη διάρκεια μιας αντίδρασης οξείδωσης-αναγωγής, κατά την καθίζηση θειούχων, υδροξειδίων, ανθρακικών, χρωμικών, φωσφορικών κ.λπ.
Ακολουθούν ορισμένες περιπτώσεις χρήσης τους για σκοπούς ανάλυσης:
Ρυθμιστικό διάλυμα οξικού (CH3COOH + CH 3 COO Na ; pH = 5) χρησιμοποιείται για την καθίζηση ιζημάτων που δεν μπορούν να καταβυθιστούν σε όξινα ή αλκαλικά διαλύματα. Οι βλαβερές επιδράσεις των οξέων καταστέλλονται από το οξικό νάτριο, το οποίο αντιδρά με ένα ισχυρό οξύ. Για παράδειγμα:
HC1 + CH 3 COO N a → CH 3 COOH + Na C1
ή σε ιοντική μορφή
H + + CH 3 COO → CH 3 COOH.
Ρυθμιστικό διάλυμα αμμωνίας-αμμωνίου ( N H 4 OH + N H 4 C1; pH = 9) χρησιμοποιείται για την καθίζηση βαρίου, στροντίου, ανθρακικού ασβεστίου και τον διαχωρισμό τους από ιόντα μαγνησίου. κατά την καθίζηση θειούχων νικελίου, κοβαλτίου, ψευδαργύρου, μαγγανίου, σιδήρου. καθώς και κατά την απελευθέρωση υδροξειδίων αλουμινίου, χρωμίου, βηρυλλίου, τιτανίου, ζιρκονίου, σιδήρου κ.λπ.
Μυρμηκικό ρυθμιστικό διάλυμα (HCOOH + HCOOΝ ΕΝΑ; pH = 2) χρησιμοποιείται για τον διαχωρισμό των ιόντων ψευδαργύρου που κατακρημνίζονται στη μορφή ZnS παρουσία ιόντων κοβαλτίου, νικελίου, μαγγανίου, σιδήρου, αλουμινίου και χρωμίου.
Ρυθμιστικό διάλυμα φωσφορικών ( N a 2 NPO 4 + N aH 2 RO; pH = 8) χρησιμοποιείται σε πολλές αντιδράσεις οξείδωσης-αναγωγής.
Για την επιτυχή χρήση ρυθμιστικών μειγμάτων για αναλυτικούς σκοπούς, είναι απαραίτητο να θυμάστε ότι δεν είναι κάθε ρυθμιστικό μείγμα κατάλληλο για ανάλυση. Το ρυθμιστικό μίγμα επιλέγεται ανάλογα με τον σκοπό του. Πρέπει να ικανοποιεί μια ορισμένη ποιοτική σύνθεση και τα συστατικά του πρέπει να υπάρχουν στο διάλυμα σε ορισμένες ποσότητες, καθώς η επίδραση των ρυθμιστικών μειγμάτων εξαρτάται από την αναλογία των συγκεντρώσεων των συστατικών τους.
Τα παραπάνω μπορούν να παρουσιαστούν σε μορφή πίνακα.
Ρυθμιστικά διαλύματα που χρησιμοποιούνται στην ανάλυση
|
Μίγμα ρυθμιστικού διαλύματος |
Σύνθεση μείγματος (σε μοριακή αναλογία 1:1) |
pH |
|
Μορφοποίηση |
Μυρμηκικό οξύ και μυρμηκικό νάτριο |
|
|
Βενζοϊκό |
Βενζοϊκό οξύ και βενζοϊκό αμμώνιο |
|
|
Οξικό άλας |
Οξεικό οξύ και οξικό νάτριο |
|
|
Φωσφορικό άλας |
Φωσφορικό μονο- και δι-νάτριο |
|
|
Αμμώνιο |
Υδροξείδιο αμμωνίου και χλωριούχο αμμώνιο |
Μείγματα αλάτων οξέος με διαφορετική υποκατάσταση υδρογόνου από μέταλλο έχουν επίσης ρυθμιστικό αποτέλεσμα. Για παράδειγμα, σε ένα ρυθμιστικό μίγμα διόξινου φωσφορικού και όξινου φωσφορικού νατρίου, το πρώτο άλας παίζει το ρόλο ενός ασθενούς οξέος και το δεύτερο το ρόλο του άλατος του.
Μεταβάλλοντας τη συγκέντρωση ενός ασθενούς οξέος και του άλατος του, είναι δυνατό να ληφθούν ρυθμιστικά διαλύματα με καθορισμένες τιμές pH.
Οι ζωικοί και φυτικοί οργανισμοί έχουν επίσης πολύπλοκα ρυθμιστικά συστήματα που διατηρούν σταθερό pH αίματος, λέμφου και άλλων υγρών. Το έδαφος έχει επίσης ρυθμιστικές ιδιότητες, οι οποίες τείνουν να εξουδετερώνουν τους εξωτερικούς παράγοντες που αλλάζουν το pH του εδαφικού διαλύματος, για παράδειγμα, όταν εισάγονται οξέα ή βάσεις στο έδαφος.
ΣΥΜΠΕΡΑΣΜΑ
Έτσι, οι λύσεις buffer είναι λύσεις που υποστηρίζουνσταθερή τιμή pH όταν αραιώνεται και προστίθενται μικρές ποσότητες οξέος ή βάσης. Μια σημαντική ιδιότητα των ρυθμιστικών διαλυμάτων είναι η ικανότητά τους να διατηρούν σταθερή τιμή pH κατά την αραίωση του διαλύματος. Τα διαλύματα οξέων και βάσεων δεν μπορούν να ονομαστούν ρυθμιστικά διαλύματα, γιατί Όταν αραιωθούν με νερό, το pH του διαλύματος αλλάζει. Τα πιο αποτελεσματικά ρυθμιστικά διαλύματα παρασκευάζονται από διαλύματα ασθενούς οξέος και του άλατος του ή ασθενούς βάσης και του άλατος του
Τα ρυθμιστικά διαλύματα μπορούν να θεωρηθούν ως μίγματα ηλεκτρολυτών που έχουν τα ίδια ιόντα. Οι λύσεις buffer διαδραματίζουν σημαντικό ρόλο σε πολλές τεχνολογικές διαδικασίες. Χρησιμοποιούνται, για παράδειγμα, στην ηλεκτροχημική εφαρμογή προστατευτικών επιστρώσεων, στην παραγωγή βαφών, δέρματος και φωτογραφικών υλικών. Τα ρυθμιστικά διαλύματα χρησιμοποιούνται ευρέως στη χημική ανάλυση και για τη βαθμονόμηση των μετρητών pH.
Πολλά βιολογικά υγρά είναι ρυθμιστικά διαλύματα. Για παράδειγμα, το pH του αίματος στο ανθρώπινο σώμα διατηρείται μεταξύ 7,35 και 7,45. γαστρικό υγρό από 1,6 έως 1,8. σάλιο από 6,35 έως 6,85. Τα συστατικά τέτοιων διαλυμάτων είναι ανθρακικά, φωσφορικά άλατα και πρωτεΐνες. Σε βακτηριολογικές μελέτες, κατά την ανάπτυξη βακτηρίων, είναι επίσης απαραίτητο να χρησιμοποιηθούν ρυθμιστικά διαλύματα.
ΒΙΒΛΙΟΓΡΑΦΙΚΟΣ ΚΑΤΑΛΟΓΟΣ
1. Kreshkov A.P. Βασικές αρχές αναλυτικής χημείας. Βιβλίο 1. - Μ: Χημεία, 1965. -498 σελ.
2. Τσίτοβιτς Ι.Κ. Μάθημα αναλυτικής χημείας: Εγχειρίδιο για πανεπιστήμια. - Αγία Πετρούπολη: “Lan”, 2007 - 496 σελ.
3. Kreshkov A.P., Yaroslavtsev A.A. Μάθημα αναλυτικής χημείας. Βιβλίο 1. Ποιοτική ανάλυση - 2η έκδ. αναθεωρημένη. - Μ.: Χημεία, 1964 - 432 σελ.
4. Χημεία: βιβλίο αναφοράς για μαθητές γυμνασίου και υποψήφιους στα πανεπιστήμια / Εκδ. Lydia R.A., Alikberova L.Yu. - Μ.:ΑΣΤ-ΣΧΟΛΕΙΟ ΤΥΠΟΥ, 2007. -512s.
5. Osipov Yu.S., Great Russian Encyclopedia: σε 30 τόμους T.4.- M.: Great Russian Encyclopedia 2006. - 751 σ.
6. Mikhailenko Ya.I., Εισαγωγή στη χημική ανάλυση, Goskhimtekhizdat, 1933.
Μέγεθος: px
Ξεκινήστε την εμφάνιση από τη σελίδα:
Αντίγραφο
2 Βασικές ερωτήσεις: 1. Ρυθμιστικά συστήματα, σύνθεση και μηχανισμός δράσης τους 2. Ρυθμιστικά διαλύματα οξικών, φωσφορικών, αμμωνίας, διττανθρακικών, αιμοσφαιρίνης 3. Υπολογισμός pH ρυθμιστικών διαλυμάτων. 4. Ρυθμιστική ικανότητα και παράγοντες που την επηρεάζουν 5. Η σημασία των ρυθμιστικών συστημάτων για τη χημεία και τη βιολογία, την ιατρική και τη φαρμακευτική
3 Κατά τη διάρκεια της μεταβολικής διαδικασίας, το σώμα μας απελευθερώνει πολλά οξέα: υδροχλωρικό, πυροσταφυλικό και γαλακτικό. Αλλά διατηρείται αυστηρά στο σώμα. Η σταθερότητα του pH των βιολογικών μέσων διατηρείται όχι μόνο από φυσιολογικούς μηχανισμούς (πνευμονική και νεφρική αντιστάθμιση), αλλά με φυσικοχημικό ρυθμιστικό διάλυμα, ανταλλαγή ιόντων και διάχυση. Η διατήρηση της ισορροπίας οξέος-βάσης σε ένα δεδομένο επίπεδο διασφαλίζεται σε μοριακό επίπεδο με τη δράση ρυθμιστικών συστημάτων.
4 Τα διαλύματα που διατηρούν σταθερή τιμή pH όταν προστίθενται μικρές ποσότητες ισχυρών οξέων και αλκαλίων, καθώς και όταν αραιώνονται, ονομάζονται πρωτολυτικά ρυθμιστικά συστήματα. Η ικανότητα ορισμένων διαλυμάτων να διατηρούν σταθερή συγκέντρωση ιόντων υδρογόνου ονομάζεται ρυθμιστική δράση, η οποία είναι ο κύριος μηχανισμός της πρωτολυτικής ομοιόστασης. Τα ρυθμιστικά διαλύματα είναι μείγματα ασθενούς βάσης ή ασθενούς οξέος και του άλατος τους. Στα ρυθμιστικά διαλύματα, σύμφωνα με τη θεωρία του Brønsted Lowry, τα κύρια «ενεργά» συστατικά είναι οι δότες και οι δέκτες πρωτονίων.
5 Τα ρυθμιστικά διαλύματα μπορούν να παρασκευαστούν με δύο τρόπους: 1. Μερική εξουδετέρωση ενός ασθενούς ηλεκτρολύτη με έναν ισχυρό ηλεκτρολύτη: CH 3 COOH (περίσσεια) + NaOH. NaOH (περίσσεια) + HCl 2. Με ανάμειξη διαλυμάτων ασθενών ηλεκτρολυτών με τα άλατά τους (ή δύο άλατα): CH 3 COOH και CH 3 COONa. NH3 και NH4Cl; NaH 2 PO 4 και Na 2 NPO 4
6 Ο λόγος για την εμφάνιση μιας νέας ποιότητας ρυθμιστικής δράσης στα διαλύματα είναι ο συνδυασμός πολλών πρωτολυτικών ισορροπιών B (βάση) + H + HB + (συζευγμένο οξύ) HA (οξύ) H + + A - (συζευγμένη βάση) Συζυγές οξύ -τα ζεύγη βάσεων HB + /Vi NA/A - ονομάζονται ρυθμιστικά συστήματα, τα οποία αντιπροσωπεύουν συνδυασμένες ισορροπίες διεργασιών ιονισμού και υδρόλυσης.
7 Έτσι, τα πρωτολυτικά buffer συστήματα αποτελούνται από δύο στοιχεία. I. αδύναμος συζευγμένος. όξινη βάση II. η αδύναμη βάση είναι συζευγμένη. οξύ Ένα από τα συστατικά δεσμεύει το Η + ενός ισχυρού οξέος, το άλλο ΟΗ - ενός ισχυρού αλκαλίου.
8 ΤΑΞΙΝΟΜΗΣΗ ρυθμιστικών συστημάτων I. Οξικά ρυθμιστικά συστήματα. Είναι ένα μείγμα ενός ασθενούς οξέος ΗΑ (δότης πρωτονίων) και του άλατος του Α - (δέκτης πρωτονίων). q οξικό: CH 3 COOH + CH 3 COONa CH CH 3 3 COOH COO q υδρογονανθρακικό: Ασθενές οξύ Συζευγμένη βάση H 2 CO HCO 3 3
9 II. Βασικά συστήματα buffer. Είναι ένα μείγμα ασθενούς βάσης (δέκτης πρωτονίων) και άλατος της (δότης πρωτονίων). Σύστημα ρυθμιστικού διαλύματος αμμωνίας: ένα μείγμα ασθενούς βάσης NH 3 H 2 O (δέκτης πρωτονίων) και ισχυρού ηλεκτρολυτικού άλατος NH + 4 (δότης πρωτονίων). Ρυθμιστική ζώνη pr 8,2-10,2 NH 4 NH OH + 4 Ασθενής βάση Συζυγές οξύ
10 III. Ρυθμιστικά συστήματα αλατιού. KH 2 PO 4 + K 2 HPO 4 εντός του κυττάρου NaH 2 PO 4 + Na 2 HPO 4 εκτός του κυττάρου ρυθμιστικό σύστημα υδροφωσφορικών (ζώνη ρύθμισης pH 6,2 8,2). Είναι ένα μείγμα ασθενούς οξέος H 2 PO - 4 (δότης πρωτονίων) ieesolinro 2-4 (δέκτης πρωτονίων) H 2 PO HPO Ασθενούς οξέος Συζυγής βάση
11 IV. Ρυθμιστικά συστήματα αμινοξέων και πρωτεϊνών. Το ρυθμιστικό αποτέλεσμα αυτών των ρυθμιστικών συστημάτων αρχίζει να εμφανίζεται όταν προστίθεται σε αυτά μια ορισμένη ποσότητα οξέος ή αλκαλίου. Σχηματίζεται ένα μείγμα δύο μορφών πρωτεΐνης: α) ένα ασθενές «πρωτεΐνη-οξύ» + ένα άλας αυτού του ασθενούς οξέος β) μια ασθενή «πρωτεϊνική βάση» + ένα άλας αυτής της ασθενούς βάσης
12 Υπολογισμός ρυθμιστικών συστημάτων pH (εξίσωση Henderson-Hasselbach) Χρησιμοποιώντας το παράδειγμα ενός ρυθμιστικού διαλύματος οξικού, ας εξετάσουμε τον υπολογισμό των ρυθμιστικών συστημάτων. CH COOH CH COONa Το οξικό νάτριο σχεδόν 3 αποσυντίθεται πλήρως σε ιόντα: CH 3 COONa CH 3 COO - + H + 3 οξικό οξύ διασπάται μόνο σε μικρό βαθμό: CH 3 COOH CH 3 COO - + H + Ας εφαρμόσουμε τον νόμο της μάζας δράση στην εξίσωση διάστασης οξικού οξέος:
13 Παρουσία οξικού νατρίου, η ισορροπία διάστασης του οξικού οξέος μετατοπίζεται έντονα προς τα αριστερά σύμφωνα με την αρχή του Le Chatelier. Σχεδόν όλο το οξύ σε ένα τέτοιο διάλυμα είναι σε μη διασπασμένη μορφή και μόνο μια μικρή ποσότητα του διασπάται, σχηματίζοντας ιόντα Η+ και παρέχοντας ένα όξινο περιβάλλον διαλύματος. Επομένως, η συγκέντρωση ισορροπίας του αδιάσπαστου οξέος σε αυτό το διάλυμα είναι πρακτικά ίση με τη συνολική του συγκέντρωση, δηλ. C(CH 3 COOH) ισούται. C(οξύ). Η συγκέντρωση των οξικών ιόντων στο ρυθμιστικό μίγμα είναι σχεδόν ίση με την αρχική συγκέντρωση άλατος: C(CH 3 COO -) C(άλας).
14 Στην εξίσωση της σταθεράς διάστασης του οξικού οξέος, αντικαθιστούμε τη συνολική συγκέντρωση του οξέος και του άλατος, παίρνουμε K d = C C k you Λαμβάνοντας το λογάριθμο αυτής της εξίσωσης και αντιστρέφοντας τα πρόσημα, παίρνουμε: άλατα, logс = log k d C k εσείς άλατα Αφού log C (H +) = pH, και lgkd = pk οξύ, τότε + = K d C C k εσείς αλάτι
15 ph = pk σε εσάς lg C C σε εσάς άλατα ή ph = pk σε εσάς + lg C C άλατα ενός οξέος Αυτή η εξίσωση ονομάζεται εξίσωση Henderson-Hesselbach. Αυτή είναι η βασική εξίσωση που χρησιμοποιείται για να περιγράψει την ισορροπία οξέος-βάσης σε βιολογικά συστήματα.
16 Μετά από παρόμοιο συμπέρασμα για βασικά ρυθμιστικά συστήματα: poh ph = = 14 pk βασικό pk + βασικό lg C lg C (άλατα) (βάσεις) C C (άλατα) (βάσεις) Από τις εξισώσεις είναι σαφές ότι το pH ενός όξινου ( βάσης) το ρυθμιστικό σύστημα εξαρτάται από τη φύση του ασθενούς ηλεκτρολύτη (pk (οξύ), pk (βάση), από την αναλογία των συγκεντρώσεων άλατος και οξέος (βάση) και τη θερμοκρασία.
17 Πρέπει να σημειωθεί ότι τα ρυθμιστικά συστήματα διατηρούνται αποτελεσματικά στο ακόλουθο εύρος: pk (οξέα) ±1 για όξινα συστήματα. 14 (pk(βάση)±1) για βασικά συστήματα. Μηχανισμός δράσης ρυθμιστικών συστημάτων. 1.Αραίωση. Όταν αραιώνονται με νερό, οι συγκεντρώσεις οξέος και άλατος μειώνονται κατά τον ίδιο αριθμό φορών, αλλά η αναλογία lg C (άλας)/C (οξύ) δεν αλλάζει, επομένως το pH του ρυθμιστικού διαλύματος πρακτικά δεν αλλάζει. Επιπλέον, το pH του οξέος ή το pH της βάσης είναι ανεξάρτητο από την αραίωση. 2.Προσθήκη οξέων και βάσεων. Όταν μια μικρή ποσότητα ισχυρού οξέος προστίθεται στο ρυθμιστικό διάλυμα οξικών, ιόν + (σχηματίζεται από διαχωρισμούς)
18 δεσμεύονται από οξικά ιόντα, που περιέχονται σε περίσσεια, για να σχηματίσουν μόρια CH 3 COOH με ασθενώς διάσταση. Ο βαθμός διάστασης του CH 3 COOH είναι μικρός και η συγκέντρωση του [H + ] παραμένει πρακτικά αμετάβλητη· το pH του ρυθμιστικού διαλύματος θα μειωθεί, αλλά μόνο ελαφρά. CH 3 COOH CH 3 COONa + HCl CH 3 COOH + NaCl x x x x ρυθμιστικό διάλυμα rnfl pH = rk k you + log C C αλάτι k you x + x
19 Όταν προστίθεται μικρή ποσότητα NaOH, τα ιόντα ΟΗ - εξουδετερώνονται από το όξινο συστατικό του ρυθμιστικού διαλύματος, σχηματίζοντας μόρια νερού. Ρυθμιστικό διάλυμα CH 3 COOH + NaOH CH 3 COONa + H 2 O x x x CH 3 COONa Ως αποτέλεσμα, η προστιθέμενη ισχυρή βάση αντικαθίσταται από μια ισοδύναμη ποσότητα της ασθενούς συζυγούς βάσης CH 3 COO -, η οποία έχει μικρότερη επίδραση στην αντίδραση του το μεσαίο. Το pH του ρυθμιστικού διαλύματος αυξάνεται, αλλά ελαφρώς.
20 pH pH = pk you + lg C C άλας k you + x x Παράδειγμα: συγκρίνετε τη μεταβολή του pH όταν περάσετε 0,01 mol υδροχλωρίου μέσα από 1 λίτρο: Οξικό ρυθμιστικό διάλυμα που περιέχει 0,1 mol/l καθένα άλατος και οξέος. v Απεσταγμένο νερό Η αρχική τιμή pH του ρυθμιστικού διαλύματος είναι ίση με pH = pH 3 COOH = 4,75, επειδή C σε σας = C αλάτι Μετά την προσθήκη HCl: pH = 4,75 + log 0,1 0,01 0,1 + 0,01 pH = 4,66; ΔρΝ = 4, = 0,09 μονάδες pH
21 v pH = 7 για απεσταγμένο νερό. Μετά τη διέλευση 0,01 mol HCl ph = -lg 0,01 = 2; ΔρΝ = 7 2 = 5 μονάδες pH Η ικανότητα ενός ρυθμιστικού διαλύματος να διατηρεί το pH καθώς προστίθεται ισχυρό οξύ ή ισχυρό αλκάλιο σε περίπου σταθερό επίπεδο δεν είναι καθόλου απεριόριστη και περιορίζεται από την τιμή της λεγόμενης ρυθμιστικής ικανότητας.
22 ΡΥΘΜΙΣΤΙΚΗ ΙΚΑΝΟΤΗΤΑ Ρυθμιστικό διάλυμα (Β) είναι ο αριθμός των γραμμομορίων ισοδύναμων ενός ισχυρού οξέος ή αλκαλίου που πρέπει να προστεθεί σε 1 λίτρο ρυθμιστικού διαλύματος για να μετατοπιστεί το pH του κατά ένα. Η ρυθμιστική ικανότητα του συστήματος προσδιορίζεται σε σχέση με το προστιθέμενο οξύ (Β οξύ) ή βάση (αλκάλιο) (βάση Β) και υπολογίζεται χρησιμοποιώντας τους τύπους: Β οξύ. = C H (HA) ph - ph 0 V(HA), V(b.p.) H Βασικό =, ph - ph V(B) V(b.p.) όπου V(HA), V(B) - όγκοι προστιθέμενου οξέος ή αλκαλίου, l.; C n = (HA), C n (B) μοριακές συγκεντρώσεις του ισοδύναμου οξέος και αλκαλίου, αντίστοιχα. V(b.r.) - όγκος του αρχικού ρυθμιστικού διαλύματος, l.; pH o, pH - τιμές pH του ρυθμιστικού διαλύματος πριν και μετά την προσθήκη οξέος ή αλκαλίου. rn-rn o - διαφορά συντελεστή. Γ (Β) 0
23 Η ρυθμιστική ικανότητα σε σχέση με το οξύ (σε οξύ) καθορίζεται από τη συγκέντρωση (αριθμός ισοδυνάμων) του συστατικού και τις βασικές του ιδιότητες. Η χωρητικότητα του ρυθμιστικού διαλύματος σε σχέση με τη βάση (Β) προσδιορίζεται από τη συγκέντρωση (αριθμός ισοδυνάμων) των ιδιοτήτων του συστατικού και του οξέος στο ρυθμιστικό διάλυμα.
24 Η χωρητικότητα του ρυθμιστικού διαλύματος εξαρτάται από την αναλογία των συστατικών και τη συγκέντρωσή τους α) αναλογία συστατικών αλάτι οξύ 90 mmol 10 mmol = = = mmol HCl + 10 mmol HCl = = log4 = 0,60 log0,67 = -0,17 = 0,67 Η χωρητικότητα του ρυθμιστικού διαλύματος είναι μέγιστη με αναλογία συστατικών ίση με μονάδα, με Β βασικό = Β οξύ, arn = pk
25 β) συγκέντρωση συστατικών. Όσο μεγαλύτερη είναι η συγκέντρωση, τόσο μεγαλύτερη είναι η χωρητικότητα του ρυθμιστικού διαλύματος. αλάτι οξύ 20 mmol 50 = 1 = 1 20 mmol mmol HCl + 10 mmol HCl = 0,33 = 0, log0,33 = 0,48 log0,67 = -0,17
26 Η χρήση οποιουδήποτε ρυθμιστικού συστήματος περιορίζεται σε ένα συγκεκριμένο εύρος pH: για όξινα συστήματα pH = όξινο pH ±1. για βασικά συστήματα рН = 14 - (рк βάση ±1). ΣΥΜΠΕΡΑΣΜΑ: Η ρυθμιστική ικανότητα εξαρτάται κυρίως από την αναλογία των συγκεντρώσεων των συστατικών και τις απόλυτες συγκεντρώσεις τους, άρα και την αραίωση. Ρυθμιστικά συστήματα αίματος Η σταθερότητα του pH των σωματικών υγρών διατηρείται από ρυθμιστικά συστήματα: υδρογονανθρακικά, αιμοσφαιρίνη, φωσφορικά, πρωτεΐνες. Η δράση όλων των ρυθμιστικών συστημάτων στο σώμα είναι αλληλένδετη, γεγονός που παρέχει βιολογικά υγρά με σταθερή τιμή pH. Στο σώμα του ανθρώπου και των ζώων, τα ρυθμιστικά συστήματα βρίσκονται στο αίμα (πλάσμα και ερυθρά αιμοσφαίρια), στα κύτταρα και στους μεσοκυττάριους χώρους άλλων ιστών.
27 Τα συστήματα ρυθμιστικού διαλύματος αίματος αντιπροσωπεύονται από συστήματα ρυθμιστικού διαλύματος πλάσματος και συστήματα ρυθμιστικού διαλύματος ερυθροκυττάρων. Ρυθμιστικά συστήματα πλάσματος αίματος Bicarbonate 35% Protein. 7% Φωσφορικό 2% pH=7,4 44% Ο ρόλος του τελευταίου είναι ασήμαντος. Αντιπροσωπεύουν το 44% της ρυθμιστικής ικανότητας του αίματος. Ρυθμιστικά συστήματα ερυθροκυττάρων pH = 7,25 αιμοσφαιρίνη 35% διττανθρακικό 18% 56% Οργανικό φωσφορικό σύστημα 3% Αντιπροσωπεύουν το 56% της ρυθμιστικής ικανότητας του αίματος.
28 ΡΥΘΜΙΣΤΙΚΟ ΣΥΣΤΗΜΑ ΥΔΡΟΑΝΘΡΑΚΩΝ Το ρυθμιστικό σύστημα υδρογονανθρακικών αντιπροσωπεύει το 53% της συνολικής ρυθμιστικής ικανότητας του αίματος (35% στο πλάσμα, 18% στα ερυθροκύτταρα). Είναι σχεδόν αδύνατο να μετρηθεί άμεσα η συγκέντρωση του ανθρακικού οξέος στο αίμα. Επομένως, η συγκέντρωση του διοξειδίου του άνθρακα εισάγεται στην εξίσωση Henderson-Hasselbach. Αυτή η εξίσωση έχει την ακόλουθη μορφή: pH = 6,1 + log όπου pk = log(n 2 CO 3) = 6,1
29 Στην πράξη, στο αίμα μετράται η μερική πίεση του διοξειδίου του άνθρακα CO 2. Η συγκέντρωση του CO 2 διαλυμένου στο πλάσμα υπολογίζεται πολλαπλασιάζοντας με τη σταθερά διαλυτότητας του CO 2. Εάν εκφράζεται σε kilopascals (kPa), η σταθερά είναι 0,23 , εάν σε mm. rt. Τέχνη. 0,03. Επομένως, εάν το P CO 2 εκφράζεται σε kPa, η εξίσωση παίρνει την ακόλουθη μορφή: pH = 6,1 + lg Η μερική πίεση του CO 2 στο πλάσμα αίματος είναι κανονικά ~ 5,3 kPa (40 mmHg), που αντιστοιχεί στη συγκέντρωση CO 2 ~ 1,2 mmol/l.
30 Η μερική πίεση του CO 2 στο πλάσμα του αίματος είναι κανονικά ~ 5,3 kPa (40 mm Hg), που αντιστοιχεί σε συγκέντρωση CO 2 ~ 1,2 mmol/l. Η συγκέντρωση διττανθρακικών ιόντων στο εξωκυτταρικό υγρό σε P CO 2 = 5,3 kPa είναι 24 mmol/l. Η αναλογία στο εξωκυττάριο υγρό [HCO - 3]/[CO 2 ] (και οι δύο τιμές σε mmol/l) είναι 20:1. Σύμφωνα με την εξίσωση Henderson Hasselbach, αυτή η αναλογία αντιστοιχεί σε τιμή pH στο πλάσμα αίματος 7,4: pH = 6,1 + log24/1,2 = 6,1 + log20 = 6,1 + 1,3 = 7,4 Έτσι, ενεργό Η αντίδραση του πλάσματος αρτηριακού αίματος των υγιών ατόμων αντιστοιχεί σε pH = 7,40.
31 Δεδομένου ότι υπάρχουν περισσότερα διττανθρακικά στο αίμα από , το σύστημα ρυθμιστικού διαλύματος αίματος είναι πολύ μεγαλύτερο για τα οξέα παρά για τις βάσεις. Αυτό έχει μεγάλη βιολογική σημασία, γιατί Κατά τη διάρκεια της μεταβολικής διαδικασίας σχηματίζονται περισσότερα οξέα παρά βάσεις. Η συγκέντρωση καθορίζει την εφεδρική αλκαλικότητα του αίματος. Το αλκαλικό απόθεμα αίματος προσδιορίζεται από τον όγκο του διοξειδίου του άνθρακα που απορροφάται από 100 cm 3 αίματος κατά την επαφή με ένα μείγμα αερίων που περιέχει 5,5% CO 2 σε πίεση 40 mmHg, που αντιστοιχεί στην πίεση του διοξειδίου του άνθρακα στο πνεύμονες. Κανονικά, το αλκαλικό απόθεμα του αίματος είναι 50-65% (όγκος) CO 2.
32 Μειωμένη αναλογία:< 20 является причиной ацидоза. Различают газовый инегазовый ацидоз. Ацидоз газовый возникает при высокой концентрации СО 2 во вдыхаемом воздухе, заболевании органов дыхания (пневмония), угнетение дыхательного центра (анестетики, седативные препараты). Негазовый ацидоз возникает при накоплении нелетучих продуктов обмена, при ожогах и воспалительных процессах. Повышение соотношения [НСО 3- ]/ [СО 2 ]>20 οδηγεί σε ασβεστόζη.
33 Αέρια αλκάλωση Πνευμονία, άσθμα Συνέπεια υπεραερισμού, συμπεριλαμβανομένου του εντατικού αερισμού των πνευμόνων (μειωμένη συγκέντρωση CO 2). Μη αέρια αλκάλωση Απώλεια μεγάλων ποσοτήτων HCl μέσω εμετού Απομάκρυνση μεγάλων ποσοτήτων H + κατά τη λήψη διουρητικών Εισαγωγή μεγάλων ποσοτήτων NaHCO 3 Μακροχρόνια λήψη μεταλλικών νερών με μεγάλη σόδα. αλκάλια
34 Κύριες κλινικές εκδηλώσεις οξέωσης και αλκάλωσης Οξέωση: Καταστολή του ΚΝΣ, σε pH κάτω από 7 η κατάθλιψη φτάνει σε τέτοιο βαθμό που χάνεται ο προσανατολισμός. το άτομο πέφτει σε κωματώδη κατάσταση. Αυξημένη αναπνοή για την απομάκρυνση του διοξειδίου του άνθρακα ως προσαρμοστική αντίδραση Αλκάλωση: Υπερδιέγερση του νευρικού συστήματος, η οποία συνοδεύεται από τετονικές (σπασμωδικές) συσπάσεις. μπορεί να συμβεί θάνατος από τετονική σύσπαση των αναπνευστικών μυών
35 Διόρθωση της οξεοβασικής κατάστασης του σώματος. Ως επείγον βοήθημα για την οξέωση, χρησιμοποιείται ενδοφλέβια έγχυση διαλυμάτων διττανθρακικού νατρίου, αλλά όταν χορηγείται, ως αποτέλεσμα εξουδετέρωσης, απελευθερώνεται CO 2, γεγονός που μειώνει την αποτελεσματικότητα του φαρμάκου. Η τρισαμίνη, η οποία δεσμεύει την περίσσεια πρωτονίων, δεν έχει αυτό το μειονέκτημα: H 2 N-C(CH 2 OH) 3 + H + H 3 N + -C(CH 2 OH) 3. Το γαλακτικό νάτριο χρησιμοποιείται επίσης ως μέσο διόρθωσης της οξέωσης. Για την εξάλειψη των φαινομένων της αλκάλωσης, το διάλυμα ασκορβικού οξέος χρησιμοποιείται ως ένα από τα προσωρινά μέτρα.
36 Αλλαγές στο pH είναι επίσης πιθανές σε άλλες περιοχές του σώματος, για παράδειγμα σε διάφορα μέρη του πεπτικού συστήματος, ειδικά στο στομάχι. Όταν η οξύτητα του γαστρικού υγρού είναι χαμηλή, συνταγογραφείται αραιωμένο υδροχλωρικό οξύ· όταν είναι υψηλή, συνταγογραφούνται διάφορα αντιόξινα: βασικό ανθρακικό μαγνήσιο Mg(OH) 2 4 MgCO 3 H 2 O, οξείδιο μαγνησίου, ανθρακικό ασβέστιο και ηρεμαγίνη (κοκκία που περιέχουν βασικό ανθρακικό μαγνήσιο και διττανθρακικό νάτριο) . Η βάση της φαρμακολογικής δράσης όλων αυτών των φαρμάκων είναι η p-εξουδετέρωση
37 Ρυθμιστικό σύστημα αιμοσφαιρίνης Το ρυθμιστικό σύστημα αιμοσφαιρίνης βρίσκεται μόνο στα ερυθρά αιμοσφαίρια. Ο μηχανισμός δράσης του σχετίζεται με την προσθήκη και την απελευθέρωση οξυγόνου. Από αυτή την άποψη, η αιμοσφαιρίνη (Hb) έχει οξειδώσει HHbO 2 και ανηγμένες μορφές HHb. HHb + O 2 HHbO 2 H + + HbO - 2 οξύ HHb H + + Hb συζευγμένη βάση οξέος Μηχανισμός δράσης με βάση αντιδράσεις: συζευγμένη βάση
38 HbO - 2+ H + HHbO 2 HHb + O 2 βάση HHbO 2 οξύ HHb + OH HbO H 2 O + OH Hb + H 2 O οξύ Hb + H + HHb βάση Από τις παραπάνω σχηματικές αντιδράσεις είναι σαφές ότι η προσθήκη του ένα ισχυρό οξύ ή ισχυρό αλκάλιο προκαλεί μια προστατευτική αντίδραση του ρυθμιστικού συστήματος για τη διατήρηση μιας σταθερής τιμής pH του μέσου, η οποία εξηγείται από τη δέσμευση των προστιθέμενων Η+ και ΟΗ και το σχηματισμό ηλεκτρολυτών χαμηλής διάστασης.
39 Το ρυθμιστικό σύστημα αιμοσφαιρίνης στο σώμα λειτουργεί αποτελεσματικά μόνο σε συνδυασμό με το σύστημα διττανθρακικών. 1. Πλάσμα αίματος Στο πλάσμα του αίματος, λόγω του ρυθμιστικού συστήματος διττανθρακικών, συμβαίνουν διάφορες αντιδράσεις, με αποτέλεσμα να σχηματίζεται διοξείδιο του άνθρακα. H 2 CO 3 + OH - H 2 O + HCO 3 - HCO 3 + H + H 2 CO 3 CO 2 H 2 O Από το πλάσμα του αίματος, το CO 2 διαχέεται στα ερυθρά αιμοσφαίρια, όπου το ένζυμο καρβονική ανυδράση καταλύει την αλληλεπίδρασή του με νερό, σχηματίζοντας ανθρακικό οξύ. 2. Ερυθρά αιμοσφαίρια H 2 O + CO 2 H 2 CO 3
40 Στα ερυθροκύτταρα, η συγκέντρωση των διττανθρακικών ιόντων αυξάνεται σύμφωνα με το ακόλουθο σχήμα: Hb - + H 2 CO 3 HHb + HCO - 3 Τα διττανθρακικά ιόντα που προκύπτουν διαχέονται στο εξωκυτταρικό υγρό. Το φλεβικό αίμα επιστρέφει στους πνεύμονες, η αιμοσφαιρίνη αντιδρά με το οξυγόνο και σχηματίζεται οξυαιμοσφαιρίνη. 3. Πνεύμονες Η οξυαιμοσφαιρίνη αντιδρά με όξινα ανθρακικά ιόντα HHb + O 2 HHbO 2. HHbO 2 + HCO 3- HBO 2- + H 2 CO 3 H 2 CO 3 H 2 O + CO 2 CO 2 απομακρύνεται από τους πνεύμονες στην ατμόσφαιρα λόγω πνευμονικού αερισμού. Αυτός είναι, καταρχήν, ο μηχανισμός για τη διατήρηση της ισορροπίας οξέος-βάσης.
41 Συστήματα ρυθμιστικών πρωτεϊνών Τα συστήματα ρυθμιστικών πρωτεϊνών είναι αμφολυτικά, γιατί. περιέχουν α αμινοξέα που περιέχουν ομάδες με όξινες ιδιότητες (COOH και NH + 3) και βασικές ιδιότητες (COO και NH 2). Ο μηχανισμός δράσης ενός τέτοιου ρυθμιστικού συστήματος μπορεί να αναπαρασταθεί ως εξής: ρυθμιστικό σύστημα οξέος α) H 3 N + R COOH +OH H 3 N + R COO + H 2 O πρωτεϊνικό οξύ β) H 3 N + R COO +H + H 3 N + R COOH άλας πρωτεϊνικού οξέος (συζευγμένη βάση)
42 κύριο ρυθμιστικό σύστημα α) H 2 N R COO + H + H 3 N + R COO πρωτεϊνική βάση β) H 3 N + R COO + OH H 2 N R COO + H 2 O πρωτεϊνικό άλας βάσης (συζυγές οξύ) όπου R είναι ένα μακρομοριακό υπόλειμμα σκίουρος. Ο ρόλος των πρωτεϊνών του πλάσματος του αίματος στην ομοιόσταση των ιόντων υδρογόνου είναι πολύ μικρός. Ρυθμιστικό σύστημα φωσφορικών Το ρυθμιστικό σύστημα φωσφορικών βρίσκεται τόσο στο αίμα όσο και στο κυτταρικό υγρό άλλων ιστών, ιδιαίτερα των νεφρών.
43 Στα κύτταρα αντιπροσωπεύεται από KH 2 PO 4 ik 2 HPO 4, στο πλάσμα του αίματος και τον μεσοκυττάριο χώρο - NaH 2 PO 4 και Na 2 HPO 4. Τον κύριο ρόλο στο μηχανισμό δράσης αυτού του συστήματος παίζει το H 2 PO - 4 ιόν: H 2 PO - 4 H + + H 2 PO 2-4 οξύ αντιστ. βάση Η αύξηση της συγκέντρωσης του Η + οδηγεί σε μετατόπιση της αντίδρασης προς τα αριστερά, δηλ. σχηματισμός οξέος: HPO 2-4 H + + H 2 PO - 4 οξύ αντιστ. βάση Το ρυθμιστικό διάλυμα φωσφορικών του αίματος βρίσκεται σε στενή σύνδεση με το ρυθμιστικό διάλυμα διττανθρακικών. H 2 CO 3 + NPO 2-4 Na HCO 3 + H 2 PO - 4 στο αίμα και στα ούρα
44 Ρυθμιστικό σύστημα αμμωνίου Σχηματίζεται στους νεφρούς από γλουταμίνη υπό την επίδραση της γλουταμινάσης στην αντίδραση της οξειδωτικής απαμίνωσης. NH 3 H + NH + 4 poh = pk +lg NH 4 OH+R COOH R COONH 4
45 Χρήση του BS σε άλλες περιοχές Τα ρυθμιστικά διαλύματα εδάφους αποτρέπουν την υπερβολική αύξηση της οξύτητας ή της αλκαλικότητας, δημιουργώντας και διατηρώντας έτσι συνθήκες για τη ζωή των φυτών. Δημιουργία περιβάλλοντος με συγκεκριμένη τιμή pH στην επιστημονική έρευνα και σε πολλές τεχνολογικές διεργασίες παραγωγής.Παρασκευή τυποποιημένων ρυθμιστικών διαλυμάτων, τα οποία χρησιμοποιούνται για τη ρύθμιση οργάνων μέτρησης ενεργού οξύτητας. Για τη διατήρηση σταθερών τιμών του ηλεκτροχημικού δυναμικού του συστήματος, χρησιμοποιούνται BS, η βάση του οποίου είναι η ισορροπία.
Κύρια ερωτήματα: 1. Ρυθμιστικά συστήματα, σύνθεση και μηχανισμός δράσης τους 2. Ρυθμιστικά διαλύματα οξικών, φωσφορικών, αμμωνίας, υδρογονανθρακικών, αιμοσφαιρίνης 3. Υπολογισμός pH ρυθμιστικών διαλυμάτων. 4. Προσωρινή χωρητικότητα και παράγοντες
ΣΥΣΤΗΜΑΤΑ ΑΜΟΡΦΩΣΗΣ. 1. Ορισμός, ταξινόμηση, σύνθεση του buffer συστήματος. 2. Μηχανισμός δράσης buffer. 3. Παραγωγή του τύπου για συστήματα ρυθμιστικού pH. 4. Ιδιότητες ρυθμιστικών συστημάτων: επίδραση στην αναλογία pH
ΡΩΣΙΚΟ ΕΘΝΙΚΟ ΕΡΕΥΝΗΤΙΚΟ ΙΑΤΡΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ Γενική και βιοοργανική χημεία Μάθημα διαλέξεων για φοιτητές ιατρικής, παιδιατρικής, Μόσχας και οδοντιατρικών σχολών Θέμα 6
ΔΙΑΛΕΞΕΙΣ 910. Buffer συστήματα. 1 Τα ρυθμιστικά συστήματα είναι ένας συνδυασμός πολλών ουσιών σε ένα διάλυμα που του προσδίδουν ρυθμιστικές ιδιότητες, δηλ. την ικανότητα να αντέχει τις αλλαγές στην ενεργό αντίδραση του περιβάλλοντος (ph) κατά την αραίωση,
Ομοσπονδιακό κρατικό προϋπολογισμό Εκπαιδευτικό Ίδρυμα Ανώτατης Εκπαίδευσης VORONEZH ΚΡΑΤΙΚΟ ΑΓΡΟΤΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΜΕ ΤΟ ΟΝΟΜΑ ΤΟΥ ΑΥΤΟΚΡΑΤΟΡΑ PETER I Τμήμα Χημείας Περίληψη έκθεση για τα ανόργανα
Θέμα μαθήματος: BUFFER SOLUTIONS. Σκοπός του μαθήματος. Κατανόηση της σύνθεσης, της ταξινόμησης και του μηχανισμού δράσης των ρυθμιστικών συστημάτων. Μάθετε να εφαρμόζετε θεωρητικό υλικό για τον υπολογισμό του pH και του ρυθμιστικού διαλύματος
Κρατικό δημοσιονομικό εκπαιδευτικό ίδρυμα τριτοβάθμιας επαγγελματικής εκπαίδευσης "ΚΡΑΤΙΚΟ ΙΑΤΡΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ IRKUTSK" του Υπουργείου Υγείας του Τμήματος της Ρωσικής Ομοσπονδίας
ΥΠΟΥΡΓΕΙΟ ΠΑΙΔΕΙΑΣ ΚΑΙ ΕΠΙΣΤΗΜΗΣ ΤΗΣ ΡΩΣΙΚΗΣ ΟΜΟΣΠΟΝΔΙΑΣ ΚΡΑΤΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ NOVOSIBIRSK ΕΙΔΙΚΟ ΚΕΝΤΡΟ ΕΚΠΑΙΔΕΥΣΗΣ ΚΑΙ ΕΡΕΥΝΑΣ Χημική ισορροπία σε διαλύματα Novosibirsk 01 Acid-BASE
4. Έννοια των ρυθμιστικών διαλυμάτων Ορισμός των ρυθμιστικών συστημάτων και η ταξινόμηση τους Πολλές αντιδράσεις σε ένα διάλυμα προχωρούν προς την επιθυμητή κατεύθυνση μόνο σε μια ορισμένη συγκέντρωση ιόντων Η+. Αλλάζοντάς το σε αυτό
Παράδειγμα. Κατασκευάστε ένα διάγραμμα κατανομής για ένα διάλυμα φωσφορικού οξέος στην περιοχή pH, 0,0. Υπολογίστε τα μοριακά κλάσματα των σωματιδίων σε pH =, 5, 9,. Ισορροπίες που εμφανίζονται σε διάλυμα φωσφορικού οξέος:
Ομοσπονδιακό κρατικό προϋπολογισμό εκπαιδευτικό ίδρυμα τριτοβάθμιας εκπαίδευσης VORONEZH ΚΡΑΤΙΚΟ ΑΓΡΟΤΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΜΕ ΤΟ ΟΝΟΜΑ ΤΟΥ ΑΥΤΟΚΡΑΤΟΡΑ ΠΕΤΡΟΥ Ι Τμήμα Χημείας Περίληψη έκθεση Βιολογικό
ΥΔΡΟΛΥΣΗ Γενικές έννοιες Η υδρόλυση είναι μια αντίδραση ανταλλαγής μεταξύ ουσιών και νερού, που οδηγεί στην αποσύνθεσή τους. Ανόργανες και οργανικές ουσίες διαφόρων κατηγοριών μπορούν να υποστούν υδρόλυση.
2 3 ΕΙΣΑΓΩΓΗ Υψηλό επίπεδο γνώσεων, ακαδημαϊκή και κοινωνική κινητικότητα, επαγγελματισμός ειδικών, ετοιμότητα για αυτομόρφωση και αυτοβελτίωση είναι οι απαιτήσεις του σήμερα. Εξαιτίας αυτού
ΥΠΟΥΡΓΕΙΟ ΥΓΕΙΑΣ ΤΗΣ ΟΥΚΡΑΝΙΑΣ ΕΘΝΙΚΟ ΙΑΤΡΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ KHARKIV BUFFER SYSTEMS, Ο ΒΙΟΛΟΓΙΚΟΣ ΡΟΛΟΣ ΤΟΥΣ Οδηγίες για την ανεξάρτητη εργασία των πρωτοετών φοιτητών στον κλάδο
Ατομική εργασία 5. ΔΕΙΚΤΗΣ ΥΔΡΟΓΟΝΟΥ ΠΕΡΙΒΑΛΛΟΝΤΟΣ. ΥΔΡΟΛΥΣΗ ΑΛΑΤΙΟΥ ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Οι ηλεκτρολύτες είναι ουσίες που μεταφέρουν ηλεκτρικό ρεύμα. Η διαδικασία αποσύνθεσης μιας ουσίας σε ιόντα υπό την επίδραση ενός διαλύτη
Κρατικό δημοσιονομικό εκπαιδευτικό ίδρυμα τριτοβάθμιας επαγγελματικής εκπαίδευσης ΚΡΑΤΙΚΟ ΙΑΤΡΙΚΟ ΚΑΙ ΟΔΟΝΤΙΑΤΡΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΜΟΣΧΑΣ του Υπουργείου Υγείας και Κοινωνικής Ανάπτυξης
Σεμινάριο 1. Ισορροπία σε ομογενές σύστημα, οξεοβασική ισορροπία, χρήση στην ογκομέτρηση (συγγραφέας: Ph.D. Monogarova O.V.). Η αναλυτική χημεία είναι η επιστήμη του προσδιορισμού της χημικής σύστασης των ουσιών
Μάθημα 5 ΔΕΙΚΤΗΣ ΥΔΡΟΓΟΝΟΥ ΠΕΡΙΒΑΛΛΟΝΤΟΣ. ΥΔΡΟΛΥΣΗ ΑΛΑΤΙΟΥ Θέμα μαθήματος 1. Εισαγωγικός έλεγχος με θέμα «Υδρόλυση περιβάλλοντος. Υδρόλυση αλάτων». 2. Σεμινάριο με θέμα «Αντιδράσεις ανταλλαγής ηλεκτρολυτών. Υδρογόνο
Τα ρυθμιστικά συστήματα αίματος (από το αγγλικό buffer, buff to soften the blow) είναι φυσιολογικά συστήματα και μηχανισμοί που παρέχουν όξινη βάση. 43765414836 Ρυθμιστικά συστήματα, ρυθμιστικά διαλύματα, ρυθμιστικά μείγματα, συστήματα,
ΜΑΘΗΜΑ 5 ΔΕΙΚΤΗΣ ΥΔΡΟΓΟΝΟΥ ΠΕΡΙΒΑΛΛΟΝΤΟΣ. ΥΔΡΟΛΥΣΗ ΑΛΑΤΙΟΥ ΘΕΩΡΗΤΙΚΟ ΜΕΡΟΣ Οι ηλεκτρολύτες είναι ουσίες που μεταφέρουν ηλεκτρικό ρεύμα. Η διαδικασία αποσύνθεσης μιας ουσίας σε ιόντα υπό την επίδραση ενός διαλύτη ονομάζεται ηλεκτρολυτική
Γενική χημεία Μαθητής: Ομάδα: Ημερομηνία υποβολής: Σκοπός εργασίας: Εργαστηριακή εργασία 8 ΛΥΣΕΙΣ ΗΛΕΚΤΡΟΛΥΤΩΝ Εμπειρία 1. Εξάρτηση της ηλεκτρικής αγωγιμότητας των διαλυμάτων από το βαθμό διάστασης των ηλεκτρολυτών Βασικές έννοιες:
ΥΠΟΥΡΓΕΙΟ ΥΓΕΙΑΣ ΟΥΚΡΑΝΙΑΣ ΖΑΠΟΡΙΖΙΕ ΚΡΑΤΙΚΟ ΙΑΤΡΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΤΜΗΜΑ ΦΥΣΙΚΗΣ ΚΑΙ ΚΟΛΛΟΕΙΔΗΣ ΧΗΜΕΙΑΣ ΜΕΘΟΔΟΛΟΓΙΚΕΣ ΟΔΗΓΙΕΣ ΓΙΑ ΠΡΑΚΤΙΚΑ ΜΑΘΗΜΑΤΑ ΚΑΙ ΕΡΓΑΣΤΗΡΙΑΚΗ ΕΡΓΑΣΙΑ
3 Διαλύματα ηλεκτρολυτών Τα υγρά διαλύματα χωρίζονται σε διαλύματα ηλεκτρολυτών που μπορούν να μεταφέρουν ηλεκτρικό ρεύμα και σε διαλύματα μη ηλεκτρολυτών που δεν είναι ηλεκτρικά αγώγιμα. Διαλυμένο σε μη ηλεκτρολύτες
Διάλεξη 6 Οξεοβασικές ισορροπίες 1 Σχέδιο διάλεξης 1. Γενικές ιδιότητες χημικής ισορροπίας. 2. Ηλεκτρολυτική διάσταση. Οξέα και βάσεις κατά Arrhenius. 3. Οξύτητα διαλυμάτων. ph. Σταθερές
Υδρόλυση. Προϊόν διαλυτότητας Θέμα 11 Συνθήκες για την εκδήλωση αντιδράσεων μεταξύ ηλεκτρολυτών Οι αντιδράσεις στα διαλύματα ηλεκτρολυτών είναι αντιδράσεις μεταξύ ιόντων Απαραίτητη προϋπόθεση για να συμβούν αντιδράσεις στα διαλύματα
Διάλεξη 5 Πρωτολυτικές ισορροπίες σε διαλύματα αλάτων (υδρόλυση). Ρυθμιστικά διαλύματα. Διάλυμα ιζήματος ισορροπίας. Προϊόν διαλυτότητας. ΠΡΩΤΟΛΥΤΙΚΗ ΙΣΟΡΡΟΠΙΑ ΣΕ ΔΙΑΛΥΜΑΤΑ ΑΛΛΑΤΙΚΗΣ ΥΔΡΟΛΥΣΗΣ ΑΛΛΗΛΕΠΙΔΡΑΣΗ
Τι είναι το ΟΞΥ και η ΒΑΣΗ; ΟΞΙΝΟΒΑΣΙΚΗ ΙΣΟΡΡΟΠΙΑ Η ζωή είναι ένας αγώνας όχι ενάντια στην αμαρτία, όχι ενάντια στη δύναμη του χρήματος, αλλά ενάντια στα ιόντα υδρογόνου Arrhenius, 1894 Bronsted-Lowry, 1923 Lewis, 1923
1. Θεωρητικές βάσεις της μεθόδου Διάλεξη 2 Μέθοδος οξέος-βάσης Η μέθοδος βασίζεται στην αντίδραση εξουδετέρωσης: H + + OH - H 2 O Η μέθοδος χρησιμοποιείται για τον ποσοτικό προσδιορισμό οξέων και αλκαλίων, καθώς και
Στόχοι για την εξέταση στο γνωστικό αντικείμενο «Γενική και Ανόργανη Χημεία» Μέθοδοι έκφρασης της συγκέντρωσης διαλυμάτων. Τιτλοδότηση οξέος-βάσης. 1. Στην ιατρική πρακτική, χρησιμοποιείται συχνά διάλυμα NaCl 0,9%.
ΡΩΣΙΚΟ ΟΙΚΟΝΟΜΙΚΟ ΠΑΝΕΠΙΣΤΗΜΙΟ με το όνομα G. V. PLEKHANOV Ανόργανη χημεία ΘΕΜΑ: Ηλεκτρολυτική διάσταση
1. Αναπληρώτρια Καθηγήτρια του Τμήματος Γενικής και Ανόργανης Χημείας του NUST MISIS, Υποψήφια Χημικών Επιστημών Marina Norairovna Ter-Akobyan 2. Ο βιότοπος των οξέων και των βάσεων είναι το νερό Το νερό είναι η πιο σημαντική χημική ουσία στον κόσμο
18. Ιονικές αντιδράσεις σε διαλύματα Ηλεκτρολυτική διάσταση. Ηλεκτρολυτική διάσταση είναι η διάσπαση των μορίων σε διάλυμα για να σχηματιστούν θετικά και αρνητικά φορτισμένα ιόντα. Η πληρότητα της αποσύνθεσης εξαρτάται
1. Ποιο είναι το φορτίο στον πυρήνα ενός ατόμου άνθρακα; 1) 0 2) +6 3) +12 4) -1 2. Τι κοινό έχουν τα άτομα 12 6C και 11 6C; 1) Αριθμός μάζας 2) Αριθμός πρωτονίων 3) Αριθμός νετρονίων 4) Ραδιενεργές ιδιότητες Δοκιμές εισόδου για
ΚΑΘΗΚΟΝΤΑ ΤΗΣ Ι (ΠΡΟΚΡΙΤΙΚΗΣ) ΑΝΤΙΣΤΟΙΧΗΣ ΣΤΑΔΗΣ ΤΗΣ ΟΛΥΜΠΙΑΔΑΣ «ΤΑ ΝΕΑ ΤΑΛΕΝΤΑ ΤΗΣ ΚΑΜΙΑΣ. ΧΗΜΕΙΑ» 2008/2009 ΑΚΑΔΗΜΑΪΚΟ ΕΤΟΣ Πρέπει να απαντήσετε στις εργασίες του αρχείου απαντήσεων! Στις εργασίες 1-19 πρέπει να επιλέξετε μία ή περισσότερες
Θεωρητικές βάσεις για το μάθημα «Δομική Βιοχημεία» Καθηγήτρια Svetlana Bobkova, Διδάκτωρ Χημικών Επιστημών Θέμα: Δομή του νερού. Φυσικές ιδιότητες του νερού. Διάσπαση νερού. Ιονικό προϊόν νερού.
Διαλύματα (3) Ισορροπίες σε διαλύματα ηλεκτρολυτών. rn και PR Διάλεξη του μαθήματος «Γενική και ανόργανη χημεία» για SUNT 11ης τάξης Οξεοβασικές ισορροπίες σε διαλύματα Σύμφωνα με τον Arrhenius: Ένας ηλεκτρολύτης ονομάζεται οξύ,
Ανόργανη χημεία Σκοπός εργασίας: Μαθητής: Ομάδα: Ημερομηνία ολοκλήρωσης εργασίας: Εργαστηριακή εργασία ΛΥΣΕΙΣ ΗΛΕΚΤΡΟΛΥΤΩΝ Εμπειρία 1. Ηλεκτρική αγωγιμότητα διαλυμάτων ισχυρών και ασθενών ηλεκτρολυτών Βασικό
ΕΝΟΤΗΤΑ II. ΑΝΑΛΥΤΙΚΗ ΧΗΜΕΙΑ Πρόβλημα 1 (συγγραφέας P.V. Chulkin) 1. Για να απλοποιήσουμε τη λύση, εκφράζουμε τη σύσταση της αμμόφως ως προς μια παράμετρο α: a(nh) 2 HPO (1 a)(nh)H 2 PO. Η μοριακή μάζα είναι M = 132a 115(1 a)
Λύση στην επιλογή 2 1. Η ηλεκτρονική διαμόρφωση του ανιόντος O 2 (1s 2 2s 2 2p 6) έχει τα κατιόντα Na, Mg 2. 2. Μοριακή μάζα απλής ουσίας Απλή ουσία πυρίτιο Si. Μ = ρ V m = 2,33 12,1 = 28 g/mol. 3.
Υδρόλυση αλάτων Η εργασία πραγματοποιήθηκε από μια δασκάλα της υψηλότερης κατηγορίας, την Timofeeva V.B. Τι είναι η υδρόλυση Η υδρόλυση είναι η διαδικασία μεταβολικής αλληλεπίδρασης πολύπλοκων ουσιών με το νερό Υδρόλυση Η αλληλεπίδραση του άλατος με το νερό, με αποτέλεσμα
ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΔΙΑΛΥΜΑΤΩΝ Τα διαλύματα είναι ομοιογενή (ομογενή) συστήματα που αποτελούνται από δύο ή περισσότερα συστατικά (συστατικά), οι ποσότητες των οποίων μπορεί να ποικίλλουν μέσα σε μεγάλα όρια. Το διάλυμα αποτελείται από διαλυμένο
Achinovich Olga Vladimirovna Το δόγμα των διαλυμάτων Τα διαλύματα είναι Ο διαλύτης είναι διαλυμένη ουσία - Παράδειγμα: Το νερό είναι διαλύτης εάν διαλύσετε ένα στερεό (γλυκόζη) ή αέριο (CO 2). - Κι αν
Ομοσπονδιακή Υπηρεσία Εκπαίδευσης Κρατικό Πανεπιστήμιο του Νόβγκοροντ με το όνομα Yaroslav the Wise Department of Chemistry and Ecology Buffer s Guidelines for εργαστηριακή εργασία Veliky Novgorod 2006
Negrebetsky 2008 2010 Διάλεξη 5 Διαδικασίες σε λύσεις. Πρωτολυτικές ισορροπίες ΣΗΜΑΝΤΙΚΕΣ ΕΝΝΟΙΕΣ Διεργασίες σε διαλύματα 5.1 Negrebetsky 2008 2010 1. Ισορροπίες σε υδατικά διαλύματα. Ενυδάτωση ιόντων. Πόλωση
ΔΙΑΛΕΞΗ 5 Σχέδιο διάλεξης:. Πρωτολυτικές ισορροπίες σε διαλύματα αλάτων (υδρόλυση αλάτων).. Ομαδικό αντιδραστήριο για την τρίτη αναλυτική ομάδα και ο μηχανισμός δράσης της. Ομαδικό αντιδραστήριο για τη δεύτερη αναλυτική ομάδα
Ερωτήσεις διαφορικής πίστωσης στη φαρμακευτική χημεία για φοιτητές Ιατρικών και Οδοντιατρικών σχολών 1. Οξεοβασικές ισορροπίες και συμπλοκοποίηση σε βιολογικά διαλύματα. 1. Βιογενής
Λύση στην επιλογή 1 1. Η ηλεκτρονική διαμόρφωση του κατιόντος Al 3+ (1s 2 2s 2 2p 6) έχει τα ανιόντα F, O 2. 2. Μοριακή μάζα απλής ουσίας Απλή ουσία χρυσός Au. 3. ClCH 2 CH 2 CH 2 CH 2 CH 2 CH 3 ;
1 Θεωρία. Ιοντομοριακές εξισώσεις αντιδράσεων ανταλλαγής ιόντων Οι αντιδράσεις ανταλλαγής ιόντων είναι αντιδράσεις μεταξύ διαλυμάτων ηλεκτρολυτών, ως αποτέλεσμα των οποίων ανταλλάσσουν τα ιόντα τους. Ιονικές αντιδράσεις
Υπουργείο Υγείας της Δημοκρατίας της Μολδαβίας Κρατικό Πανεπιστήμιο Ιατρικής και Φαρμακευτικής Nicolae Testemitanu Φαρμακευτική Σχολή Τμήμα Γενικής Χημείας G. V. BUDU, S. V. MELNICK ANALYTICAL
ΟΜΟΣΠΟΝΔΙΑΚΟΣ ΟΡΓΑΝΙΣΜΟΣ ΕΚΠΑΙΔΕΥΣΗΣ Κρατικό εκπαιδευτικό ίδρυμα ανώτατης επαγγελματικής εκπαίδευσης "TOMSK POLYTECHNIC UNIVERSITY" ΕΓΚΡΙΘΗΚΕ από τον Κοσμήτορα του KhTF V.M._Pogrebenkov 2007
Βασικές αρχές της θεωρίας της ηλεκτρολυτικής διάστασης Faraday Michael 22. IX.1791 25.VIII. 1867 Άγγλος φυσικός και χημικός. Στο πρώτο μισό του 19ου αι. εισήγαγε την έννοια των ηλεκτρολυτών και των μη ηλεκτρολυτών. Ουσίες
1. Τις κύριες ιδιότητες εμφανίζει το εξωτερικό οξείδιο του στοιχείου: 1) θείο 2) άζωτο 3) βάριο 4) άνθρακας 2. Ποιος από τους τύπους αντιστοιχεί στην έκφραση του βαθμού διάστασης των ηλεκτρολυτών: 1) α = n \n 2) V m = V\n 3) n =
1 ΕΝΟΤΗΤΑ 1 ΓΕΝΙΚΕΣ ΘΕΩΡΗΤΙΚΕΣ ΘΕΜΕΛΙΕΣ ΑΝΑΛΥΤΙΚΗΣ ΧΗΜΕΙΑΣ. ΘΕΜΑ ΠΟΙΟΤΙΚΗΣ ΑΝΑΛΥΣΗΣ: ΟΞΕΒΑΣΙΚΗ ΙΣΟΡΡΟΠΙΑ ΚΑΙ Ο ΡΟΛΟΣ ΤΟΥΣ ΣΤΗΝ ΑΝΑΛΥΤΙΚΗ ΧΗΜΕΙΑ (ΣΤΗΝ ΑΝΑΛΥΤΙΚΗ). BUFFER SYSTEMS ΔΙΑΛΕΞΗ 5 ΣΤΟΧΟΣ: ΝΑ ΜΟΡΦΗ
1. Ποιο από τα παρακάτω στοιχεία είναι το πιο τυπικό αμέταλλο; 1) Οξυγόνο 2) Θείο 3) Σελήνιο 4) Τελλούριο 2. Ποιο από τα παρακάτω στοιχεία έχει τη μεγαλύτερη ηλεκτραρνητικότητα; 1) Νάτριο
Υπουργείο Παιδείας της Ρωσικής Ομοσπονδίας Κρατικό Τεχνολογικό Πανεπιστήμιο Ανατολικής Σιβηρίας Σύνθετες δοκιμαστικές εργασίες γενικής και ανόργανης χημείας Μεθοδολογική ανάπτυξη για ανεξάρτητη
1 Διάλεξη 14 Ιονικές αντιδράσεις Οι χημικές αντιδράσεις στα διαλύματα ηλεκτρολυτών ανάγεται στην ανταλλαγή ιόντων. Αυτές οι αντιδράσεις χαρακτηρίζονται από πολύ υψηλά ποσοστά. Κατά τις αντιδράσεις ανταλλαγής ιόντων, οι καταστάσεις οξείδωσης
1 ΔΙΑΛΕΞΗ Περίγραμμα διάλεξης: 1. Βασικές αρχές της θεωρίας διαλυμάτων ηλεκτρολυτών. Ολική (αναλυτική) συγκέντρωση και δραστικότητα ιόντων στο διάλυμα, η σχέση τους. Ταχύτητα χημικής αντίδρασης και χημική ισορροπία.
ΚΡΑΤΙΚΟ ΙΔΡΥΜΑ ΑΝΩΤΕΡΗΣ ΕΠΑΓΓΕΛΜΑΤΙΚΗΣ ΕΚΠΑΙΔΕΥΣΗΣ "ΠΑΝΕΠΙΣΤΗΜΙΟ ΛΕΥΚΟΡΩΣΙΑΣ-ΡΩΣΙΑΣ" Τμήμα "Τεχνολογίες Μετάλλων" ΧΗΜΕΙΑ Μεθοδολογικές συστάσεις για πρακτικά μαθήματα για φοιτητές
ΔΙΑΛΕΞΗ 3 Περίγραμμα διάλεξης: 1. Συμπεριφορά ισχυρών και ασθενών μονοβασικών οξέων σε υδατικά διαλύματα. 2. Συμπεριφορά ισχυρών και ασθενών βάσεων ενός οξέος σε υδατικά διαλύματα. 3. Συμπεριφορά ισχυρών και αδύναμων πολυβάσεων
Διάλεξη 14 Αντιδράσεις ανταλλαγής σε διαλύματα ηλεκτρολυτών. Προϊόν διαλυτότητας. Διάσπαση νερού. Υδρόλυση αλάτων Βασικές έννοιες: αντιδράσεις ανταλλαγής ιόντων, μοριακές εξισώσεις ιόντων, προϊόν διαλυτότητας
ΛΥΣΕΙΣ στα προβλήματα της Ολυμπιάδας «FUTURE OF KUZBASS» στη χημεία 1. Να πραγματοποιήσετε τους μετασχηματισμούς: Mg MgO MgSO 4 Mg(OH) 2 Mg(OH)Cl MgCl 2 Li Li 2 O LiOH LiH 2 PO 4 Li 2 HPO 4 Li 3 PO 4 La La 2 O 3 La(OH) 2 NO 3 La(OH) 3
1 ΔΙΑΛΕΞΗ 5 ΚΛΙΝΙΚΗ ΠΑΘΟΦΥΣΙΟΛΟΓΙΑ ΔΙΑΤΑΡΑΧΕΣ ΠΕΡΙΕΧΟΜΕΝΟΥ ΟΞΙΝΟΒΑΣΗΣ 1. ΕΙΣΑΓΩΓΗ 2. ΓΕΝΙΚΕΣ ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ABL 3. Η ΣΗΜΑΣΙΑ ΤΗΣ ΣΥΝΕΧΗΣ ABL ΓΙΑ ΤΟ ΣΩΜΑ 4. ΣΥΝΕΠΕΙΕΣ
ΧΗΜΕΙΑ. ΓΕΝΙΚΗ ΚΑΙ ΑΝΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ. ΥΔΡΟΛΥΣΗ ΑΛΑΤΙΟΥ ΥΔΡΟΛΥΣΗ ΑΛΑΤΟΥ Κατά τη μελέτη της επίδρασης ενός καθολικού δείκτη στα διαλύματα ορισμένων αλάτων, παρατηρούνται τα εξής: Όπως βλέπουμε, το περιβάλλον του πρώτου
Δείκτης pH υδρογόνου Δείκτες Η ουσία της υδρόλυσης Τύποι αλάτων Αλγόριθμος σύνθεσης εξισώσεων για την υδρόλυση αλάτων Υδρόλυση διαφόρων τύπων αλάτων Μέθοδοι καταστολής και ενίσχυσης της υδρόλυσης Λύση δοκιμών Β4 Υδρογόνο
1. Δώστε παραδείγματα για τη χρήση αντιδράσεων συμπλοκοποίησης στη μέθοδο ανάλυσης οξέος-βάσης. Γράψτε τις εξισώσεις αντίδρασης. Χρησιμοποιούνται αντιδράσεις συμπλοκοποίησης της μεθόδου ανάλυσης οξέος-βάσης
Στάδιο πλήρους απασχόλησης. Βαθμός 11. Λύσεις. Εργασία 1. Ένα μείγμα τριών αερίων Α, Β, Γ έχει πυκνότητα υδρογόνου 14. Ένα μέρος αυτού του μείγματος βάρους 168 g διήλθε μέσω περίσσειας διαλύματος βρωμίου σε αδρανή διαλύτη
ΚΑΜΠΥΛΗ ΤΙΤΛΟΠΟΙΗΣΗΣ - ένα γράφημα της εξάρτησης μιας παραμέτρου συστήματος που σχετίζεται με τη συγκέντρωση της τιτλοδοτημένης ουσίας, του τιτλοδοτητή ή του προϊόντος αντίδρασης, από το βαθμό προόδου της διαδικασίας τιτλοδότησης (για παράδειγμα, από την ποσότητα
Συλλογή προβλημάτων στη χημεία για την 9η ιατρική τάξη που συνέταξε ο Gromchenko I.A. Μόσχα Εκπαιδευτικό Κέντρο 109 2012 Κλάσμα μάζας διαλυμένης ουσίας. 1. 250 g διαλύματος περιέχει 50 g χλωριούχου νατρίου. Καθορίζω
Κεφάλαιο 6. ΠΡΩΤΟΛΥΤΙΚΑ ΡΥΘΜΙΣΤΙΚΑ ΣΥΣΤΗΜΑΤΑ
Κεφάλαιο 6. ΠΡΩΤΟΛΥΤΙΚΑ ΡΥΘΜΙΣΤΙΚΑ ΣΥΣΤΗΜΑΤΑ
Μια αλλαγή σε οποιονδήποτε παράγοντα που μπορεί να επηρεάσει την κατάσταση της χημικής ισορροπίας ενός συστήματος ουσιών προκαλεί μια αντίδραση σε αυτό που επιδιώκει να εξουδετερώσει την αλλαγή που γίνεται.
A. Le Chatelier
6.1. ΣΥΣΤΗΜΑΤΑ ΑΜΟΡΦΩΣΗΣ. ΟΡΙΣΜΟΣ ΚΑΙ ΓΕΝΙΚΕΣ ΔΙΑΤΑΞΕΙΣ ΤΗΣ ΘΕΩΡΙΑΣ ΤΩΝ ΠΡΟΟΡΙΣΜΩΝ ΣΥΣΤΗΜΑΤΩΝ. ΤΑΞΙΝΟΜΗΣΗ ΣΥΣΤΗΜΑΤΩΝ BUFFER
Τα συστήματα που υποστηρίζουν την πρωτολυτική ομοιόσταση περιλαμβάνουν όχι μόνο φυσιολογικούς μηχανισμούς (πνευμονική και νεφρική αντιστάθμιση), αλλά και φυσικοχημικά ρυθμιστικά αποτελέσματα, ανταλλαγή ιόντων και διάχυση. Η διατήρηση της ισορροπίας οξέος-βάσης σε ένα δεδομένο επίπεδο διασφαλίζεται σε μοριακό επίπεδο με τη δράση ρυθμιστικών συστημάτων.
Τα πρωτολυτικά ρυθμιστικά συστήματα είναι διαλύματα που διατηρούν σταθερή τιμή pH τόσο κατά την προσθήκη οξέων και αλκαλίων όσο και κατά την αραίωση.
Η ικανότητα ορισμένων διαλυμάτων να διατηρούν σταθερή συγκέντρωση ιόντων υδρογόνου ονομάζεται δράση buffer,που είναι ο κύριος μηχανισμός της πρωτολυτικής ομοιόστασης. Τα ρυθμιστικά διαλύματα είναι μείγματα ασθενούς βάσης ή ασθενούς οξέος και του άλατος τους. Στα ρυθμιστικά διαλύματα, τα κύρια «ενεργά» συστατικά είναι ένας δότης και δέκτης πρωτονίων, σύμφωνα με τη θεωρία του Brønsted, ή ένας δότης και δέκτης ζεύγους ηλεκτρονίων, σύμφωνα με τη θεωρία του Lewis, που αντιπροσωπεύει ένα ζεύγος οξέος-βάσης.
Με βάση το αν ο ασθενής ηλεκτρολύτης του ρυθμιστικού συστήματος ανήκει στην κατηγορία των οξέων ή των βάσεων και ανάλογα με τον τύπο των φορτισμένων σωματιδίων χωρίζονται σε τρεις τύπους: όξινο, βασικό και αμφολυτικό. Ένα διάλυμα που περιέχει ένα ή περισσότερα ρυθμιστικά συστήματα ονομάζεται ρυθμιστικό διάλυμα. Τα ρυθμιστικά διαλύματα μπορούν να παρασκευαστούν με δύο τρόπους:
Μερική εξουδετέρωση ενός αδύναμου ηλεκτρολύτη με έναν ισχυρό ηλεκτρολύτη:
Με ανάμειξη διαλυμάτων ασθενών ηλεκτρολυτών με τα άλατά τους (ή δύο άλατα): CH 3 COOH και CH 3 COONa. NH3 και NH4Cl; NaH2PO4
και Na 2 HPO 4 .
Ο λόγος για την εμφάνιση μιας νέας ποιότητας στα διαλύματα - ρυθμιστική δράση - είναι ο συνδυασμός πολλών πρωτολυτικών ισορροπιών:
Τα συζευγμένα ζεύγη οξέος-βάσης B/BH + και A - /HA ονομάζονται ρυθμιστικά συστήματα.
Σύμφωνα με την αρχή του Le Chatelier, προσθέτοντας ένα ασθενές οξύ HB + H 2 O ↔ H 3 O + + B - ένα ισχυρό οξύ ή ένα άλας που περιέχει ανιόντα Β - σε ένα διάλυμα, εμφανίζεται μια διαδικασία ιονισμού, μετατοπίζοντας την ισορροπία προς τα αριστερά ( φαινόμενο κοινού ιόντος) B - + H 2 O ↔ HB + OH -, και η προσθήκη αλκαλίου (OH -) - προς τα δεξιά, αφού λόγω της αντίδρασης εξουδετέρωσης η συγκέντρωση των ιόντων υδρονίου θα μειωθεί.
Όταν συνδυάζονται δύο απομονωμένες ισορροπίες (ιονισμός οξέος και υδρόλυση ανιόντων), αποδεικνύεται ότι οι διεργασίες που θα συμβούν σε αυτές υπό την επίδραση των ίδιων εξωτερικών παραγόντων (προσθήκη ιόντων υδρονίου και υδροξειδίου) κατευθύνονται διαφορετικά. Επιπλέον, η συγκέντρωση ενός από τα προϊόντα καθεμιάς από τις συνδυασμένες αντιδράσεις επηρεάζει τη θέση ισορροπίας της άλλης αντίδρασης.
Το πρωτολυτικό ρυθμιστικό σύστημα είναι μια συνδυασμένη ισορροπία των διαδικασιών ιονισμού και υδρόλυσης.
Η εξίσωση του ρυθμιστικού συστήματος εκφράζει την εξάρτηση του pH του ρυθμιστικού διαλύματος από τη σύνθεση του ρυθμιστικού συστήματος:
Η ανάλυση της εξίσωσης δείχνει ότι η τιμή του pH του ρυθμιστικού διαλύματος εξαρτάται από τη φύση των ουσιών που σχηματίζουν το ρυθμιστικό σύστημα, την αναλογία των συγκεντρώσεων των συστατικών και τη θερμοκρασία (καθώς η τιμή pKa εξαρτάται από αυτήν).
Σύμφωνα με την πρωτολυτική θεωρία, τα οξέα, οι βάσεις και οι αμφολύτες είναι πρωτολύτες.
6.2. ΕΙΔΗ ΣΥΣΤΗΜΑΤΩΝ BUFFER
Ρυθμιστικά συστήματα τύπου οξέος
Τα όξινα ρυθμιστικά συστήματα είναι ένα μείγμα ενός ασθενούς οξέος ΗΒ (δότης πρωτονίων) και του άλατος του Β - (δέκτης πρωτονίων). Τείνουν να έχουν όξινο περιβάλλον (pH<7).
Ρυθμιστικό σύστημα υδρογονανθρακικών (ρυθμιστική ζώνη pH 5,4-7,4) - ένα μείγμα ασθενούς ανθρακικού οξέος H 2 CO 3 (δότης πρωτονίων) και του άλατος του HCO 3 - (δέκτης πρωτονίων).
Ρυθμιστικό σύστημα υδροφωσφορικού (ρυθμιστική ζώνη pH 6,2-8,2) - ένα μείγμα ασθενούς οξέος H 2 PO 4 - (δότης πρωτονίου) και του άλατος του HPO 4 2- (δέκτης πρωτονίων).
Το σύστημα ρυθμιστικού διαλύματος αιμοσφαιρίνης αντιπροσωπεύεται από δύο ασθενή οξέα (δότες πρωτονίων) - αιμοσφαιρίνη HHb και οξυαιμοσφαιρίνη HHbO 2 και τις συζευγμένες ασθενείς βάσεις τους (δέκτες πρωτονίων) - αιμοσφαιρινικά - Hb - και οξυαιμοσφαιρινικά ανιόντα HbO 2 -, αντίστοιχα.
Βασικά συστήματα buffer
Τα βασικά ρυθμιστικά συστήματα είναι ένα μείγμα ασθενούς βάσης (δέκτης πρωτονίων) και του άλατος της (δότης πρωτονίων). Συνήθως έχουν αλκαλικό περιβάλλον (pH >7).
Σύστημα ρυθμιστικού διαλύματος αμμωνίας: ένα μείγμα ασθενούς βάσης NH 3 H 2 O (δέκτης πρωτονίων) και του άλατος του - ένας ισχυρός ηλεκτρολύτης NH 4 + (δότης πρωτονίων). Ρυθμιστική ζώνη σε ρΗ 8,2-10,2.
Ρυθμιστικά συστήματα τύπου αμφολύτη
Τα αμφολυτικά ρυθμιστικά συστήματα αποτελούνται από ένα μείγμα δύο αλάτων ή ενός άλατος ενός ασθενούς οξέος και μιας ασθενούς βάσης, για παράδειγμα CH 3 COONH 4, στο οποίο το CH 3 COO - παρουσιάζει ασθενείς βασικές ιδιότητες - έναν δέκτη πρωτονίων και το NH 4 + - a ασθενές οξύ - δότης πρωτονίων. Ένα βιολογικά σημαντικό ρυθμιστικό σύστημα του τύπου αμφολύτη είναι το πρωτεϊνικό ρυθμιστικό σύστημα - (NH 3 +) m -Prot-(CH3COO-) n.
Τα ρυθμιστικά συστήματα μπορούν να θεωρηθούν ως ένα μείγμα αδύναμων και ισχυρών ηλεκτρολυτών που έχουν ιόντα με το ίδιο όνομα (φαινόμενο κοινό ιόν).Για παράδειγμα, σε ένα ρυθμιστικό διάλυμα οξικού υπάρχουν οξικά ιόντα και σε ένα υδρογονανθρακικό διάλυμα υπάρχουν ανθρακικά ιόντα.
6.3. ΜΗΧΑΝΙΣΜΟΣ ΔΡΑΣΗΣ ΡΥΘΜΙΣΤΙΚΩΝ ΔΙΑΛΥΜΑΤΩΝ ΚΑΙ ΠΡΟΣΔΙΟΡΙΣΜΟΣ PH ΣΤΑ ΔΙΑΛΥΜΑΤΑ ΑΥΤΑ. ΕΞΙΣΩΣΗ GENDSON-HASSELBACH
Ας εξετάσουμε τον μηχανισμό δράσης των ρυθμιστικών διαλυμάτων τύπου οξέος χρησιμοποιώντας το παράδειγμα του ρυθμιστικού συστήματος οξικών CH 3 COO - /CH 3 COOH, η δράση του οποίου βασίζεται στην οξεοβασική ισορροπία CH 3 COOH ↔ H + + CH 3 COO - (K И = 1,75 10 - 5). Η κύρια πηγή οξικών ιόντων είναι ο ισχυρός ηλεκτρολύτης CH 3 COONa. Όταν προστίθεται ένα ισχυρό οξύ, η συζευγμένη βάση CH 3 COO - δεσμεύει τα προστιθέμενα κατιόντα υδρογόνου, μετατρέποντας σε ασθενές οξύ: CH 3 COO - + + H + ↔ CH 3 COOH (η ισορροπία οξέος-βάσης μετατοπίζεται προς τα αριστερά). Η μείωση της συγκέντρωσης του CH 3 COO εξισορροπείται από την αύξηση της συγκέντρωσης ενός ασθενούς οξέος και υποδηλώνει τη διαδικασία της υδρόλυσης. Σύμφωνα με το νόμο της αραίωσης του Ostwald, μια αύξηση στη συγκέντρωση ενός οξέος μειώνει ελαφρώς τον βαθμό ηλεκτρολυτικής διάστασής του και το οξύ πρακτικά δεν ιονίζεται. Κατά συνέπεια, στο σύστημα: C σε αυξάνει, C σε και α μειώνεται, - Const, C σε /C σε αυξάνεται, όπου C to είναι η συγκέντρωση οξέος, C είναι η συγκέντρωση άλατος, α είναι ο βαθμός ηλεκτρολυτικής διάστασης.
Όταν προστίθεται αλκάλιο, τα κατιόντα υδρογόνου του οξικού οξέος απελευθερώνονται και εξουδετερώνονται από τα προστιθέμενα ιόντα OH -, δεσμεύονται σε μόρια νερού: CH 3 COOH + OH - → CH 3 COO - + H 2 O
(η οξεοβασική ισορροπία μετατοπίζεται προς τα δεξιά). Κατά συνέπεια, το C k αυξάνεται, το C c και το α μειώνεται, - το const, το C k / C c μειώνεται.
Ο μηχανισμός δράσης των ρυθμιστικών συστημάτων του βασικού και αμφολυτικού τύπου είναι παρόμοιος. Το ρυθμιστικό αποτέλεσμα του διαλύματος οφείλεται σε μια μετατόπιση της ισορροπίας οξέος-βάσης λόγω της δέσμευσης των προστιθέμενων ιόντων Η+ και ΟΗ- από τα ρυθμιστικά συστατικά και του σχηματισμού ουσιών χαμηλής διάστασης.
Ο μηχανισμός δράσης ενός ρυθμιστικού διαλύματος πρωτεΐνης κατά την προσθήκη οξέος: (NH 3 +) m -Prot-(COO -) n + nΗ+ ↔ (NH 3 +) m -Prot-(COOH) n, κατά την προσθήκη αλκαλίου - (NH 3 +) m -Prot-(COO -) n + ΜOH- ↔ (NH2) m - Prot-(COO-) n + mH2O.
Σε υψηλές συγκεντρώσεις Η + και ΟΗ - (πάνω από 0,1 mol/l), η αναλογία των συστατικών του ρυθμιστικού μίγματος αλλάζει σημαντικά - ο C σε / C αυξάνεται ή μειώνεται και το pH μπορεί να αλλάξει. Αυτό επιβεβαιώνεται από εξίσωση Henderson-Hasselbalch,που καθιερώνει την εξάρτηση των [H + ], K I, α και C προς /C s. Η εξίσωση
Αυτό το εξάγουμε χρησιμοποιώντας το παράδειγμα ενός ρυθμιστικού συστήματος τύπου οξέος - ένα μείγμα οξικού οξέος και του άλατος του CH 3 COONa. Η συγκέντρωση των ιόντων υδρογόνου στο ρυθμιστικό διάλυμα προσδιορίζεται από τη σταθερά ιοντισμού του οξικού οξέος:


Η εξίσωση δείχνει ότι η συγκέντρωση των ιόντων υδρογόνου εξαρτάται άμεσα από το KI, α, τη συγκέντρωση οξέος Ck και αντιστρόφως εξαρτάται από το Cc και την αναλογία C προς /Cc. Παίρνοντας τον λογάριθμο και των δύο πλευρών της εξίσωσης και λαμβάνοντας τον λογάριθμο με αρνητικό πρόσημο, παίρνουμε την εξίσωση σε λογαριθμική μορφή:

Η εξίσωση Henderson-Hasselbach για ρυθμιστικά συστήματα βασικού και αμφολυτικού τύπου προκύπτει χρησιμοποιώντας το παράδειγμα εξαγωγής της εξίσωσης για ρυθμιστικά συστήματα του τύπου οξέος.
Για έναν βασικό τύπο ρυθμιστικού συστήματος, για παράδειγμα αμμωνία, η συγκέντρωση κατιόντων υδρογόνου στο διάλυμα μπορεί να υπολογιστεί με βάση τη σταθερά ισορροπίας οξέος-βάσης του συζυγούς οξέος
N.H. 4 + :

Εξίσωση Henderson-Hasselbach για συστήματα buffer βασικού τύπου:
Αυτή η εξίσωση μπορεί να αναπαρασταθεί ως:
Για ένα σύστημα ρυθμιστικού διαλύματος φωσφορικών το HPO 4 2- /H 2 PO 4 - το pH μπορεί να υπολογιστεί χρησιμοποιώντας την εξίσωση:
όπου pK 2 είναι η σταθερά διάστασης του ορθοφωσφορικού οξέος στο δεύτερο στάδιο.
6.4. ΙΚΑΝΟΤΗΤΑ ΤΩΝ ΡΥΘΜΙΣΤΙΚΩΝ ΛΥΣΕΩΝ ΚΑΙ ΠΑΡΑΓΟΝΤΕΣ ΠΟΥ ΠΡΟΣΔΙΟΡΙΖΟΥΝ ΤΗΝ
Η ικανότητα των διαλυμάτων να διατηρούν σταθερή τιμή pH δεν είναι απεριόριστη. Τα ρυθμιστικά μίγματα διακρίνονται από την αντοχή τους στη δράση οξέων και βάσεων που εισάγονται στο ρυθμιστικό διάλυμα.
Η ποσότητα οξέος ή αλκαλίου που πρέπει να προστεθεί σε 1 λίτρο ρυθμιστικού διαλύματος ώστε η τιμή του pH να αλλάξει κατά ένα ονομάζεται ρυθμιστική ικανότητα.
Έτσι, η χωρητικότητα του ρυθμιστικού διαλύματος είναι ένα ποσοτικό μέτρο του ρυθμιστικού αποτελέσματος ενός διαλύματος. Ένα ρυθμιστικό διάλυμα έχει μέγιστη ρυθμιστική ικανότητα σε pH = pK του οξέος ή της βάσης σχηματίζοντας ένα μείγμα με αναλογία των συστατικών του ίση με τη μονάδα. Όσο υψηλότερη είναι η αρχική συγκέντρωση του ρυθμιστικού μίγματος, τόσο μεγαλύτερη είναι η ρυθμιστική του ικανότητα. Η χωρητικότητα του ρυθμιστικού διαλύματος εξαρτάται από τη σύνθεση του ρυθμιστικού διαλύματος, τη συγκέντρωση και την αναλογία των συστατικών.
Πρέπει να είστε σε θέση να επιλέξετε το σωστό σύστημα buffer. Η επιλογή καθορίζεται από το απαιτούμενο εύρος pH. Η ρυθμιστική ζώνη δράσης προσδιορίζεται από την ισχύ του οξέος (βάσης) ±1 μονάδα.
Κατά την επιλογή ενός ρυθμιστικού μίγματος, είναι απαραίτητο να λαμβάνεται υπόψη η χημική φύση των συστατικών του, καθώς οι ουσίες του διαλύματος στο οποίο προστίθενται
ρυθμιστικό σύστημα, μπορεί να σχηματίσει αδιάλυτες ενώσεις και να αλληλεπιδράσει με τα συστατικά του ρυθμιστικού συστήματος.
6.5. ΣΥΣΤΗΜΑΤΑ ΡΥΘΜΙΣΗΣ ΑΙΜΑΤΟΣ
Το αίμα περιέχει 4 κύρια ρυθμιστικά συστήματα.
1. Υδρογονανθρακικό. Αντιπροσωπεύει το 50% της χωρητικότητας. Λειτουργεί κυρίως στο πλάσμα και παίζει κεντρικό ρόλο στη μεταφορά CO 2.
2. Πρωτεΐνη. Αντιπροσωπεύει το 7% της χωρητικότητας.
3. Αιμοσφαιρίνη, αποτελεί το 35% της χωρητικότητας. Αντιπροσωπεύεται από την αιμοσφαιρίνη και την οξυαιμοσφαιρίνη.
4. Σύστημα ρυθμιστικού διαλύματος υδροφωσφορικών - χωρητικότητα 5%. Τα συστήματα ρυθμιστικού διαλύματος υδρογονανθρακικών και αιμοσφαιρίνης λειτουργούν
κεντρικό και εξαιρετικά σημαντικό ρόλο στη μεταφορά του CO 2 και στη δημιουργία pH. Το pH του πλάσματος του αίματος είναι 7,4. Το CO 2 είναι προϊόν του κυτταρικού μεταβολισμού που απελευθερώνεται στο αίμα. Διαχέεται μέσω της μεμβράνης στα ερυθρά αιμοσφαίρια, όπου αντιδρά με το νερό για να σχηματίσει H 2 CO 3. Η αναλογία ορίζεται στο 7 και το pH θα είναι 7,25. Η οξύτητα αυξάνεται και λαμβάνουν χώρα οι ακόλουθες αντιδράσεις:

Το προκύπτον HCO 3 - εξέρχεται μέσω της μεμβράνης και παρασύρεται από την κυκλοφορία του αίματος. Στο πλάσμα του αίματος, το pH είναι 7,4. Όταν το φλεβικό αίμα επιστρέφει στους πνεύμονες, η αιμοσφαιρίνη αντιδρά με το οξυγόνο για να σχηματίσει οξυαιμοσφαιρίνη, η οποία είναι ένα ισχυρότερο οξύ: HHb + + O 2 ↔ HHbO 2. Το pH μειώνεται, καθώς σχηματίζεται ένα ισχυρότερο οξύ, λαμβάνει χώρα η αντίδραση: HHbO 2 + HCO 3 - ↔ HbO 2 - + H 2 CO 3. Στη συνέχεια, το CO 2 απελευθερώνεται στην ατμόσφαιρα. Αυτός είναι ένας από τους μηχανισμούς για τη μεταφορά CO 2 και O 2.
Η ενυδάτωση και η αφυδάτωση του CO 2 καταλύεται από το ένζυμο καρβονική ανυδράση, το οποίο βρίσκεται στα ερυθρά αιμοσφαίρια.
Οι βάσεις δεσμεύονται επίσης από το ρυθμιστικό διάλυμα αίματος και απεκκρίνονται στα ούρα, κυρίως με τη μορφή μονο- και διβασικών φωσφορικών αλάτων.
Στις κλινικές, προσδιορίζεται πάντα η εφεδρική αλκαλικότητα του αίματος.
6.6. ΕΡΩΤΗΣΕΙΣ ΚΑΙ ΑΣΚΗΣΕΙΣ ΓΙΑ ΝΑ ΑΥΤΟΔΟΚΙΜΑΣΤΕ ΤΗΝ ΠΡΟΕΤΟΙΜΑΣΙΑ ΣΑΣ ΓΙΑ ΜΑΘΗΜΑΤΑ ΚΑΙ ΕΞΕΤΑΣΕΙΣ
1. Όταν συνδυάζονται ποιες πρωτολυτικές ισορροπίες θα έχουν τα διαλύματα ρυθμιστικές ιδιότητες;
2.Δώστε την έννοια των συστημάτων buffer και της δράσης buffer. Ποια είναι η χημεία της ρυθμιστικής δράσης;
3. Κύριοι τύποι ρυθμιστικών διαλυμάτων. Ο μηχανισμός της ρυθμιστικής τους δράσης και η εξίσωση Henderson-Hasselbach που καθορίζει το pH στα ρυθμιστικά συστήματα.
4.Τα κύρια ρυθμιστικά συστήματα του σώματος και η σχέση τους. Από τι εξαρτάται το pH των ρυθμιστικών συστημάτων;
5. Πώς ονομάζεται η χωρητικότητα του buffer ενός συστήματος προσωρινής αποθήκευσης; Ποιο ρυθμιστικό σύστημα αίματος έχει τη μεγαλύτερη χωρητικότητα;
6. Μέθοδοι λήψης ρυθμιστικών διαλυμάτων.
7. Επιλογή ρυθμιστικών διαλυμάτων για ιατρική και βιολογική έρευνα.
8. Προσδιορίστε εάν παρατηρείται οξέωση ή αλκάλωση σε έναν ασθενή εάν η συγκέντρωση ιόντων υδρογόνου στο αίμα είναι 1.2.10 -7 mol/l;
6.7. ΕΡΓΑΣΙΕΣ ΔΟΚΙΜΗΣ
1. Ποιο από τα προτεινόμενα συστήματα είναι σύστημα προσωρινής αποθήκευσης;
α)HCl και NaCl.
β)H2SO4 και NaHSO4;
γ) Η 2 CO 3 και NaHCO 3;
δ)HNO 3 και NaNO 3;
ε)HClO4 και NaClO4.
2. Για ποιο από τα προτεινόμενα ρυθμιστικά συστήματα αντιστοιχεί ο τύπος υπολογισμού pH = pK;
α) 0,1 Μ διάλυμα NaH 2 PO 4 και 0,1 Μ διάλυμα Na 2 HPO 4;
β) 0,2 Μ διάλυμα H 2 CO 3 και 0,3 Μ διάλυμα NaHC0 3;
γ) 0,4 Μ διάλυμα NH 4 OH και 0,3 M διάλυμα NH 4 Cl;
δ) Διάλυμα 0,5 Μ CH 3 COOH και 0,8 Μ διάλυμα CH 3 COONa.
ε) Διάλυμα NaHCO 0,4 M 3 και 0,2 Μ διάλυμα H 2 CO 3.
3. Ποιο από τα προτεινόμενα ρυθμιστικά συστήματα είναι ένα ρυθμιστικό σύστημα διττανθρακικών;
α) NH 4 OH και NH 4 Cl .
β)H2CO3 και KNSO3;
γ) NaH2PO4 και Na2HPO4;
δ) CH 3 COOH και CH 3 COOK.
ε) K 2 HPO 4 και KN 2 PO 4.
4. Κάτω από ποιες συνθήκες το pH του ρυθμιστικού συστήματος είναι ίσο με pK k;
α) όταν οι συγκεντρώσεις του οξέος και του άλατος του είναι ίσες.
β) όταν οι συγκεντρώσεις του οξέος και του άλατος του δεν είναι ίσες.
γ) όταν η αναλογία των όγκων του οξέος και του άλατος του είναι 0,5.
δ) όταν η αναλογία των όγκων του οξέος και του άλατος του στις ίδιες συγκεντρώσεις δεν είναι ίση.
ε) όταν η συγκέντρωση οξέος είναι 2 φορές μεγαλύτερη από τη συγκέντρωση του άλατος.
5. Ποιος από τους προτεινόμενους τύπους είναι κατάλληλος για τον υπολογισμό του [H+], για το σύστημα CH 3 COOH και CH 3 ΟΠΟΤΕ, ΚΑΛΑ?

6. Ποιο από τα παρακάτω μείγματα αποτελεί μέρος του ρυθμιστικού συστήματος του σώματος;
α)HCl και NaCl.
β)H2S και NaHS;
γ) NH4OH και NH4Cl.
δ)H2CO3 και NaHC03;
ε)Ba(OH)2 και BaOHCl.
7. Τι τύπος ρυθμιστικού συστήματος οξέος-βάσης είναι ένα ρυθμιστικό διάλυμα πρωτεΐνης;
α) ένα ασθενές οξύ και το ανιόν του.
γ) ανιόντα 2 αλάτων οξέος.
ε) ιόντα και μόρια αμφολυτών.
8. Τι τύπος ρυθμιστικού συστήματος οξέος-βάσης είναι το ρυθμιστικό διάλυμα αμμωνίας;
α) ένα ασθενές οξύ και το ανιόν του.
β) ανιόντα όξινων και μεσαίων αλάτων.
γ) ανιόντα 2 αλάτων οξέος.
δ) ασθενής βάση και το κατιόν της.
ε) ιόντα και μόρια αμφολυτών.
9. Τι τύπος ρυθμιστικού συστήματος οξέος-βάσης είναι το ρυθμιστικό διάλυμα φωσφορικών;
α) ένα ασθενές οξύ και το ανιόν του.
β) ανιόντα όξινων και μεσαίων αλάτων.
γ) ανιόντα 2 αλάτων οξέος.
δ) ασθενής βάση και το κατιόν της.
ε) ιόντα και μόρια αμφολυτών.
10. Πότε ένα ρυθμιστικό σύστημα πρωτεΐνης δεν είναι ρυθμιστικό;
α) στο ισοηλεκτρικό σημείο.
β) κατά την προσθήκη αλκαλίων.
γ) κατά την προσθήκη οξέος.
δ) σε ουδέτερο περιβάλλον.
11. Ποιος από τους προτεινόμενους τύπους είναι κατάλληλος για τον υπολογισμό του συστήματος [OH - ]: NH 4 OH και NH 4 Cl;

Γενική χημεία: σχολικό βιβλίο / A. V. Zholnin; επεξεργάστηκε από V. A. Popkova, A. V. Zholnina. - 2012. - 400 σελ.: ill.
- Σε επαφή με 0
- Google+ 0
- Εντάξει 0
- Facebook 0