Η ηλεκτρόλυση είναι μια αντίδραση οξειδοαναγωγής που λαμβάνει χώρα στα ηλεκτρόδια εάν ένα σταθερό ηλεκτρικό ρεύμα περάσει μέσα από το τήγμα ή το διάλυμα ηλεκτρολύτη.
Η κάθοδος είναι ένας αναγωγικός παράγοντας που δίνει ηλεκτρόνια σε κατιόντα.
Η άνοδος είναι ένα οξειδωτικό που δέχεται ηλεκτρόνια από ανιόντα.
|
Σειρά δραστηριότητας κατιόντων: |
Na + , Mg 2+ , Al 3+ , Zn 2+ , Ni 2+ , Sn 2+ , Pb 2+ , Η+ , Cu 2+ , Ag + _____________________________→ Ενίσχυση της οξειδωτικής δύναμης |
|
Σειρά δραστηριοτήτων ανιόντων: |
I - , Br - , Cl - , OH - , NO 3 - , CO 3 2- , SO 4 2- ←__________________________________ Αύξηση της ικανότητας ανάκτησης |
Διεργασίες που συμβαίνουν στα ηλεκτρόδια κατά την ηλεκτρόλυση των τήγματος
(δεν εξαρτώνται από το υλικό των ηλεκτροδίων και τη φύση των ιόντων).
1. Τα ανιόντα εκκενώνονται στην άνοδο (Είμαι - ; ω-
A m - - m ē → A °; 4 OH - - 4ē → O 2 + 2 H 2 O (διεργασίες οξείδωσης).
2. Τα κατιόντα εκκενώνονται στην κάθοδο ( Me n + , H + ), μετατρέπονται σε ουδέτερα άτομα ή μόρια:
Me n + + n ē → Me ° ; 2 H + + 2ē → H 2 0 (διαδικασίες ανάκτησης).
Διεργασίες που συμβαίνουν στα ηλεκτρόδια κατά την ηλεκτρόλυση των διαλυμάτων
|
ΚΑΘΟΔΟΣ (-) Μην εξαρτάστε από το υλικό της καθόδου. εξαρτώνται από τη θέση του μετάλλου σε μια σειρά τάσεων |
ANOD (+) Εξαρτάται από το υλικό της ανόδου και τη φύση των ανιόντων. |
|
|
Η άνοδος είναι αδιάλυτη (αδρανής), δηλ. κατασκευασμένα από άνθρακας, γραφίτης, πλατίνα, χρυσός. |
Η άνοδος είναι διαλυτή (ενεργή), δηλ. κατασκευασμένα απόCu, Αγ, Zn, Ni, Feκαι άλλα μέταλλα (εκτόςPt, Au) |
|
|
1. Πρώτα απ 'όλα, αποκαθίστανται μεταλλικά κατιόντα, που στέκονται σε μια σειρά από τάσεις μετάH 2 : Me n+ +nē → Me° |
1. Πρώτα απ 'όλα, οξειδώνονται ανιόντα οξέων χωρίς οξυγόνο (εκτόςφά - ): A m- - mē → A° |
Τα ανιόντα δεν οξειδώνονται. Τα άτομα μετάλλου ανόδου οξειδώνονται: Me° - nē → Me n+ Κατιόντα Me n + μπείτε σε λύση. Η μάζα της ανόδου μειώνεται. |
|
2. Κατιόντα μετάλλων μέσης δραστικότητας, που στέκονται μεταξύ τουςΟ Αλ και H 2 , αποκαθίστανται ταυτόχρονα με νερό: Me n+ + nē →Me° 2H 2 O + 2ē → H 2 + 2OH - |
2. Ανιόντα οξοοξέων (ΕΤΣΙ 4 2- , CO 3 2- ,..) και φά - μην οξειδώνονται, τα μόρια οξειδώνονταιH 2 Ο : 2H 2 O - 4ē → O 2 + 4H + |
|
|
3.Κατιόντα ενεργών μετάλλων απόLi πριν Ο Αλ (συμπεριλαμβανομένου) δεν αποκαθίστανται, αλλά αποκαθίστανται τα μόριαH 2 Ο : 2 H 2 O + 2ē → H 2 + 2OH - |
3. Κατά την ηλεκτρόλυση των αλκαλικών διαλυμάτων οξειδώνονται ιόνταω- : 4OH - - 4ē → O 2 +2H 2 O |
|
|
4. Κατά την ηλεκτρόλυση των όξινων διαλυμάτων, τα κατιόντα ανάγονται H+: 2H + + 2ē → H 2 0 |
||
ΗΛΕΚΤΡΟΛΥΣΗ ΛΙΩΜΑΤΩΝ
Ασκηση 1. Κάντε ένα διάγραμμα της ηλεκτρόλυσης του τήγματος βρωμιούχου νατρίου. (Αλγόριθμος 1.)
|
Αλληλουχία |
Ανάληψη δράσεων |
|
NaBr → Na + + Br - |
|
|
K - (κάθοδος): Na +, A + (άνοδος): Br - |
|
|
K + : Na + + 1ē → Na 0 (ανάκτηση), A +: 2 Br - - 2ē → Br 2 0 (οξείδωση). |
|
|
2NaBr \u003d 2Na +Br 2 |
Εργασία 2. Κάντε ένα διάγραμμα της ηλεκτρόλυσης του τήγματος υδροξειδίου του νατρίου. (Αλγόριθμος 2.)
|
Αλληλουχία |
Ανάληψη δράσεων |
|
NaOH → Na + + OH - |
|
|
2. Δείξτε την κίνηση των ιόντων στα αντίστοιχα ηλεκτρόδια |
K - (κάθοδος): Na +, A + (άνοδος): OH -. |
|
3. Σχεδιάστε σχήματα διεργασιών οξείδωσης και αναγωγής |
K - : Na + + 1ē → Na 0 (ανάκτηση), A +: 4 OH - - 4ē → 2 H 2 O + O 2 (οξείδωση). |
|
4. Να γίνει μια εξίσωση για την ηλεκτρόλυση ενός τήγματος αλκαλίων |
4NaOH \u003d 4Na + 2H 2 O + O 2 |
Εργασία 3.Κάντε ένα διάγραμμα της ηλεκτρόλυσης ενός τήγματος θειικού νατρίου. (Αλγόριθμος 3.)
|
Αλληλουχία |
Ανάληψη δράσεων |
|
1. Να συνθέσετε την εξίσωση διάστασης άλατος |
Na 2 SO 4 → 2Na + + SO 4 2- |
|
2. Δείξτε την κίνηση των ιόντων στα αντίστοιχα ηλεκτρόδια |
Κ - (κάθοδος): Na + A + (άνοδος): SO 4 2- |
|
K -: Na + + 1ē → Na 0, A +: 2SO 4 2- - 4ē → 2SO 3 + O 2 |
|
|
4. Να γίνει μια εξίσωση για την ηλεκτρόλυση του τηγμένου αλατιού |
2Na 2 SO 4 \u003d 4Na + 2SO 3 + O 2 |
ΛΥΜΑ ΗΛΕΚΤΡΟΛΥΣΗ
Ασκηση 1.Σχεδιάστε ένα σχήμα για την ηλεκτρόλυση υδατικού διαλύματος χλωριούχου νατρίου χρησιμοποιώντας αδρανή ηλεκτρόδια. (Αλγόριθμος 1.)
|
Αλληλουχία |
Ανάληψη δράσεων |
|
1. Να συνθέσετε την εξίσωση διάστασης άλατος |
NaCl → Na + + Cl - |
|
Τα ιόντα νατρίου στο διάλυμα δεν αποκαθίστανται, επομένως το νερό αποκαθίσταται. Τα ιόντα χλωρίου οξειδώνονται. |
|
|
3. Να συντάξετε διαγράμματα των διεργασιών αναγωγής και οξείδωσης |
K -: 2H 2 O + 2ē → H 2 + 2OH - A +: 2Cl - - 2ē → Cl 2 |
|
2NaCl + 2H 2 O \u003d H 2 + Cl 2 + 2NaOH |
Εργασία 2.Σχεδιάστε ένα σχήμα για την ηλεκτρόλυση ενός υδατικού διαλύματος θειικού χαλκού ( II ) χρησιμοποιώντας αδρανή ηλεκτρόδια. (Αλγόριθμος 2.)
|
Αλληλουχία |
Ανάληψη δράσεων |
|
1. Να συνθέσετε την εξίσωση διάστασης άλατος |
CuSO 4 → Cu 2+ + SO 4 2- |
|
2. Επιλέξτε τα ιόντα που θα εκφορτιστούν στα ηλεκτρόδια |
Τα ιόντα χαλκού ανάγεται στην κάθοδο. Στην άνοδο σε ένα υδατικό διάλυμα, τα θειικά ιόντα δεν οξειδώνονται, επομένως το νερό οξειδώνεται. |
|
3. Να συντάξετε διαγράμματα των διεργασιών αναγωγής και οξείδωσης |
K - : Cu 2+ + 2ē → Cu 0 A + : 2H 2 O - 4ē → O 2 +4H + |
|
4. Να γίνει μια εξίσωση για την ηλεκτρόλυση ενός υδατικού διαλύματος άλατος |
2CuSO 4 + 2H 2 O \u003d 2Cu + O 2 + 2H 2 SO 4 |
Εργασία 3.Σχεδιάστε ένα σχήμα για την ηλεκτρόλυση υδατικού διαλύματος υδατικού διαλύματος υδροξειδίου του νατρίου χρησιμοποιώντας αδρανή ηλεκτρόδια. (Αλγόριθμος 3.)
|
Αλληλουχία |
Ανάληψη δράσεων |
|
1. Να γίνει μια εξίσωση για τη διάσταση των αλκαλίων |
NaOH → Na + + OH - |
|
2. Επιλέξτε τα ιόντα που θα εκφορτιστούν στα ηλεκτρόδια |
Τα ιόντα νατρίου δεν μπορούν να αναχθούν, επομένως το νερό μειώνεται στην κάθοδο. Τα ιόντα υδροξειδίου οξειδώνονται στην άνοδο. |
|
3. Να συντάξετε διαγράμματα των διεργασιών αναγωγής και οξείδωσης |
K -: 2 H 2 O + 2ē → H 2 + 2 OH - A +: 4 OH - - 4ē → 2 H 2 O + O 2 |
|
4. Να γίνει εξίσωση για την ηλεκτρόλυση υδατικού διαλύματος αλκαλίου |
2 H 2 O \u003d 2 H 2 + O 2 , δηλ. Η ηλεκτρόλυση ενός υδατικού διαλύματος αλκαλίου ανάγεται σε ηλεκτρόλυση νερού. |
Θυμάμαι.Στην ηλεκτρόλυση οξέων που περιέχουν οξυγόνο (H 2 SO 4 κ.λπ.), βάσεις (NaOH, Ca (OH) 2 κ.λπ.) , άλατα ενεργών μετάλλων και οξέα που περιέχουν οξυγόνο(K 2 SO 4 κ.λπ.) ηλεκτρόλυση του νερού συμβαίνει στα ηλεκτρόδια: 2 H 2 O \u003d 2 H 2 + O 2
Εργασία 4.Σχεδιάστε ένα σχήμα για την ηλεκτρόλυση ενός υδατικού διαλύματος νιτρικού αργύρου χρησιμοποιώντας μια άνοδο από άργυρο, δηλ. η άνοδος είναι διαλυτή. (Αλγόριθμος 4.)
|
Αλληλουχία |
Ανάληψη δράσεων |
|
1. Να συνθέσετε την εξίσωση διάστασης άλατος |
AgNO 3 → Ag + + NO 3 - |
|
2. Επιλέξτε τα ιόντα που θα εκφορτιστούν στα ηλεκτρόδια |
Τα ιόντα αργύρου μειώνονται στην κάθοδο και η άνοδος αργύρου διαλύεται. |
|
3. Να συντάξετε διαγράμματα των διεργασιών αναγωγής και οξείδωσης |
Κ-: Ag + + 1ē→ Ag 0 ; A+: Ag 0 - 1ē→ Ag + |
|
4. Να γίνει μια εξίσωση για την ηλεκτρόλυση ενός υδατικού διαλύματος άλατος |
Ag + + Ag 0 = Ag 0 + Ag + Η ηλεκτρόλυση ανάγεται στη μεταφορά αργύρου από την άνοδο στην κάθοδο. |
Οι χημικές αντιδράσεις που συνοδεύονται από μεταφορά ηλεκτρονίων () χωρίζονται σε δύο τύπους: αντιδράσεις που συμβαίνουν αυθόρμητα και αντιδράσεις που συμβαίνουν όταν το ρεύμα διέρχεται από ένα διάλυμα ή τήκεται .
Το διάλυμα ή το τήγμα ηλεκτρολύτη τοποθετείται σε ειδικό δοχείο - ηλεκτρολυτικό λουτρό .
Ηλεκτρική ενέργεια - αυτή είναι μια διατεταγμένη κίνηση φορτισμένων σωματιδίων - ιόντων, ηλεκτρονίων κ.λπ. υπό τη δράση ενός εξωτερικού ηλεκτρικού πεδίου. Δημιουργείται ηλεκτρικό πεδίο σε διάλυμα ηλεκτρολύτη ή τήγμα ηλεκτρόδια .
ηλεκτρόδια- Πρόκειται κατά κανόνα για ράβδους κατασκευασμένες από υλικό που μεταφέρει ηλεκτρικό ρεύμα. Τοποθετούνται σε διάλυμα ή λιώνουν ηλεκτρολύτη, και συνδέεται σε ηλεκτρικό κύκλωμα με πηγή ρεύματος.
Σε αυτή την περίπτωση, το αρνητικά φορτισμένο ηλεκτρόδιο κάθοδοςπροσελκύει θετικά φορτισμένα ιόντα κατιόντα. θετικά φορτισμένο ηλεκτρόδιο ( άνοδος) έλκει αρνητικά φορτισμένα σωματίδια ( ανιόντα). Η κάθοδος δρα ως αναγωγικός παράγοντας και η άνοδος ως οξειδωτικός παράγοντας.
Διάκριση μεταξύ ηλεκτρόλυσης και ενεργόςκαι αδρανήςηλεκτρόδια. Ενεργά (διαλυτά) ηλεκτρόδιαυφίστανται χημικούς μετασχηματισμούς κατά την ηλεκτρόλυση. Συνήθως είναι κατασκευασμένα από χαλκό, νικέλιο και άλλα μέταλλα. Αδρανή (αδιάλυτα) ηλεκτρόδιαδεν υφίστανται χημικούς μετασχηματισμούς. Είναι κατασκευασμένα από ανενεργά μέταλλα, για παράδειγμα, πλατίνα, ή γραφίτης .
Ηλεκτρόλυση διαλύματος
Διακρίνετε την ηλεκτρόλυση λύσηή τήκωχημική ουσία. Μια επιπλέον χημική ουσία υπάρχει στο διάλυμα - νερό, το οποίο μπορεί να λάβει μέρος σε αντιδράσεις οξειδοαναγωγής.
καθοδικές διεργασίες
σε λύση άλατα η κάθοδος έλκει μεταλλικά κατιόντα. Τα μεταλλικά κατιόντα μπορούν να δράσουν ως οξειδωτικά. Οι οξειδωτικές ικανότητες των μεταλλικών ιόντων διαφέρουν. Για να αξιολογήσουν τις οξειδοαναγωγικές ικανότητες των μετάλλων, χρησιμοποιούν ηλεκτροχημική σειρά τάσεων :
Κάθε μέταλλο χαρακτηρίζεται από την τιμή του ηλεκτροχημικού δυναμικού. Όσο λιγότερες δυνατότητες , Θέματα περισσότερες αποκαταστατικές ιδιότητες μέταλλο και θέματα λιγότερες οξειδωτικές ιδιότητες αντίστοιχο ιόν αυτού του μετάλλου. Διαφορετικά ιόντα αντιστοιχούν σε διαφορετικές τιμές αυτού του δυναμικού. Το ηλεκτροχημικό δυναμικό είναι μια σχετική τιμή. Το ηλεκτροχημικό δυναμικό του υδρογόνου υποτίθεται ότι είναι μηδέν.
Επίσης κοντά στην κάθοδο υπάρχουν μόρια νερό H 2 O. Το νερό περιέχει έναν οξειδωτικό παράγοντα, το ιόν Η+.
Κατά την ηλεκτρόλυση των διαλυμάτων αλάτων στην κάθοδο, παρατηρούνται οι ακόλουθες κανονικότητες:
1. Εάν το μέταλλο είναι σε αλάτι - ενεργός (έως και Al 3+ στο εύρος των τάσεων ), τότε αντί για το μέταλλο στην κάθοδο αποκαθίσταται (αποφορτισμένο) υδρογόνο, επειδή το δυναμικό του υδρογόνου είναι πολύ μεγαλύτερο. Η διαδικασία αναγωγής του μοριακού υδρογόνου από το νερό προχωρά, με το σχηματισμό ιόντων ΟΗ -, το περιβάλλον κοντά στην κάθοδο είναι αλκαλικό:
2H 2 O + 2ē → H 2 + 2OH -
Για παράδειγμα, κατά την ηλεκτρόλυση ενός διαλύματος χλωριούχο νάτριομόνο το υδρογόνο από το νερό θα ανακτηθεί στην κάθοδο.
2. Εάν το μέταλλο είναι σε αλάτι - μέση δραστηριότητα (μεταξύ Al 3+ και H +), τότε η κάθοδος αποκαθίσταται ( αποφορτίστηκε) και μέταλλο, και υδρογόνο, δεδομένου ότι το δυναμικό τέτοιων μετάλλων είναι συγκρίσιμο με το δυναμικό του υδρογόνου:
Me n+ + nē → Me 0
Για παράδειγμα, κατά την ηλεκτρόλυση ενός διαλύματος θειικού σιδήρου (II) στην κάθοδο θα ανάγεται ( απαλλάσσω) και σίδηρος και υδρογόνο:
Fe 2+ + 2ē → Fe 0
2H + 2 O + 2ē → H 2 0 + 2OH -
3. Εάν το μέταλλο είναι σε αλάτι - ανενεργό (μετά το υδρογόνο στη σειρά τυπικών ηλεκτροχημικών μετάλλων) , τότε το ιόν ενός τέτοιου μετάλλου είναι ισχυρότερος οξειδωτικός παράγοντας από το ιόν υδρογόνου, και μόνο μέταλλο:
Me n+ + nē → Me 0
Για παράδειγμα, κατά την ηλεκτρόλυση διαλύματοςθειικός χαλκός (II).ο χαλκός θα μειωθεί στην κάθοδο:
Cu 2+ + 2ē → Cu 0
4. Αν χτυπήσουν στην κάθοδο κατιόντα υδρογόνου Η+ , στη συνέχεια ανάγεται σε μοριακό υδρογόνο:
2H + + 2ē → H 2 0
Διεργασίες ανόδου
Μια θετικά φορτισμένη άνοδος προσελκύει ανιόντα και μόρια νερού. Η άνοδος είναι ένας οξειδωτικός παράγοντας. Ως αναγωγικοί παράγοντες, ενεργώ είτε ανιόντα όξινων υπολειμμάτων είτε μόρια νερού (λόγω του οξυγόνου στην κατάσταση οξείδωσης -2: Η2Ο-2).
Στην ηλεκτρόλυση διαλυμάτων αλάτων στην άνοδοπαρατηρούνται τα ακόλουθα μοτίβα:
1. Αν πάρει η άνοδος υπόλειμμα οξέος χωρίς οξυγόνο , τότε οξειδώνεται σε ελεύθερη κατάσταση (στην κατάσταση οξείδωσης 0):
neMe n- – nē = neMe 0
Για παράδειγμα: κατά την ηλεκτρόλυση ενός διαλύματος χλωριούχου νατρίου, τα ιόντα χλωρίου οξειδώνονται στην άνοδο:
2Cl - - 2ē \u003d Cl 2 0
Πράγματι, αν θυμηθούμε τον Περιοδικό Νόμο: με την αύξηση της ηλεκτραρνητικότητας ενός μη μετάλλου, μειώνονται οι αναγωγικές του ιδιότητες. Το οξυγόνο είναι το δεύτερο πιο ηλεκτραρνητικό στοιχείο. Έτσι, είναι ευκολότερο να οξειδωθεί σχεδόν οποιοδήποτε μη μέταλλο, παρά το οξυγόνο. Αλήθεια, υπάρχει ένα εξαίρεση. Μάλλον έχετε ήδη μαντέψει. Φυσικά είναι φθόριο. Εξάλλου, η ηλεκτραρνητικότητα του φθορίου είναι μεγαλύτερη από αυτή του οξυγόνου. Με αυτόν τον τρόπο, κατά την ηλεκτρόλυση των διαλυμάτων φθορίου, θα οξειδωθούν τα μόρια του νερού και όχι τα ιόντα φθορίου :
2Η2Ο-2 – 4ē → O 2 0 + 4H +
2. Αν πάρει η άνοδος υπόλειμμα οξέος που περιέχει οξυγόνο ή ιόν φθορίου , τότε το νερό υφίσταται οξείδωση με την απελευθέρωση μοριακού οξυγόνου:
2Η2Ο-2 – 4ē → O 2 0 + 4H +
3. Αν πάρει η άνοδος ιόν υδροξειδίου,τότε οξειδώνεται και απελευθερώνεται μοριακό οξυγόνο:
4 Ο-2H-– 4ē → O 2 0 + 2H 2 O
4. Στην ηλεκτρόλυση διαλυμάτων άλατα καρβοξυλικών οξέων υφίσταται οξείδωση άτομο άνθρακα της καρβοξυλικής ομάδας,απελευθερώνεται διοξείδιο του άνθρακα και το αντίστοιχο αλκάνιο.
Για παράδειγμα, στην ηλεκτρόλυση διαλυμάτων οξικάΕκλύονται διοξείδιο του άνθρακα και αιθάνιο:
2CH 3 C +3 OO – – 2ē → 2C +4 O 2 + CH 3 -CH 3
Συνολικές διαδικασίες ηλεκτρόλυσης
Εξετάστε την ηλεκτρόλυση διαλυμάτων διαφόρων αλάτων.
Για παράδειγμα, ηλεκτρόλυση διαλύματος θειικός χαλκός. Στην κάθοδοΤα ιόντα χαλκού μειώνονται:
Κάθοδος (-): Cu 2+ + 2ē → Cu 0
στην άνοδοτα μόρια οξειδώνονται νερό:
Άνοδος (+): 2Η 2Ο-2 – 4ē → O 2 + 4H +
Τα θειικά ιόντα δεν εμπλέκονται στη διαδικασία. Θα τα γράψουμε στην τελική εξίσωση με ιόντα υδρογόνου σε μορφή θειικού οξέος:
2 Cu 2+ SO 4+ 2Η2 Ο-2→ 2 Cu 0 + 2H 2 SO 4 + O 2 0
Ηλεκτρόλυση διαλύματος χλωριούχο νάτριο μοιάζει με αυτό:
Στην κάθοδοαναρρώνει υδρογόνο:
Κάθοδος (-):
στην άνοδοοξειδώνονται ιόντα χλωρίου:
Άνοδος (+): 2Cl – – 2ē → Cl 2 0
Τα ιόντα νατρίου δεν εμπλέκονται στη διαδικασία της ηλεκτρόλυσης. Τα γράφουμε με ανιόντα υδροξειδίου στη συνολική εξίσωση ηλεκτρόλυσης διαλύματος χλωριούχο νάτριο:
2H + 2 O + 2NaCl - → H 2 0 + 2NaOH + Cl 2 0
Επόμενο παράδειγμα ανθρακικό κάλιο.
Στην κάθοδοαναρρώνει υδρογόνοαπό νερό:
Κάθοδος (-): 2H + 2 O + 2ē → H 2 0 + 2OH -
στην άνοδοοξειδώνονται μόρια νερούσε μοριακό οξυγόνο:
Άνοδος (+): 2Η 2Ο-2 – 4ē → O 2 0 + 4H +
Έτσι, στο , τα ιόντα καλίου και τα ανθρακικά ιόντα δεν συμμετέχουν στη διαδικασία. Η ηλεκτρόλυση του νερού συμβαίνει:
2Η2+Ο-2 → 2H 2 0 + O 2 0
Αλλο παράδειγμα: ηλεκτρόλυση υδατικού διαλύματος χλωριούχος χαλκός (II).
Στην κάθοδοαναρρώνει χαλκός:
Κάθοδος (-): Cu 2+ + 2ē → Cu 0
στην άνοδοοξειδώνονται ιόντα χλωρίουσε μοριακό χλώριο:
Άνοδος (+): 2Cl – – 2ē → Cl 2 0
Έτσι, στο ηλεκτρόλυση διαλύματος ανθρακικού καλίουγίνεται ηλεκτρόλυση του νερού
Cu2+ Cl2– → Cu 0 + Cl 2 0
Μερικά ακόμη παραδείγματα: ηλεκτρόλυση διαλύματος υδροξειδίου του νατρίου.
Στην κάθοδοαναρρώνει υδρογόνο από το νερό:
Κάθοδος (-): 2H + 2 O + 2ē → H 2 0 + 2OH -
στην άνοδοοξειδώνονται ιόντα υδροξειδίουσε μοριακό οξυγόνο:
Άνοδος (+): 4Ο-2H-– 4ē → O 2 0 + 2H 2 O
Έτσι, στο ηλεκτρόλυση διαλύματος υδροξειδίου του νατρίουτο νερό αποσυντίθεται, τα κατιόντα νατρίου δεν συμμετέχουν στη διαδικασία:
2Η2+Ο-2 → 2H 2 0 + O 2 0
Ηλεκτρόλυση τήγματος
Κατά την ηλεκτρόλυση του τήγματος, τα ανιόντα των όξινων υπολειμμάτων οξειδώνονται στην άνοδο και τα μεταλλικά κατιόντα μειώνονται στην κάθοδο. Δεν υπάρχουν μόρια νερού στο σύστημα.
Για παράδειγμα:ηλεκτρόλυση τήγματος χλωριούχο νάτριο. Στην κάθοδοΤα κατιόντα νατρίου αποκαθίστανται:
Κάθοδος (-): Na + + ē → Na 0
στην άνοδοανιόντα οξειδώνονται χλώριο:
Άνοδος (+): 2Cl – – 2ē → Cl 2 0
τήγμα χλωριούχου νατρίου:
2Na+Cl – → 2Na 0 + Cl 2 0
Αλλο παράδειγμα:ηλεκτρόλυση τήγματος υδροξείδιο του νατρίου. Στην κάθοδο Τα κατιόντα νατρίου μειώνονται:
Κάθοδος (-): Na + + ē → Na 0
στην άνοδοοξειδώνονται ιόντα υδροξειδίου:
Άνοδος (+): 4OH – – 4ē → O 2 0+ 2Η2Ο
Η συνολική εξίσωση ηλεκτρόλυσης τήγμα υδροξειδίου του νατρίου:
4Na+Ω – → 4Na 0 + O 2 0 + 2Η2Ο
Πολλά μέταλλα λαμβάνονται στη βιομηχανία με ηλεκτρόλυση τήγματος.
Για παράδειγμα , αλουμίνιοπου λαμβάνεται με ηλεκτρόλυση διαλύματος οξείδιο αργιλίουστο λιώσιμο του κρυόλιθου. Κρυόλιθος- Το Na 3 τήκεται σε χαμηλότερη θερμοκρασία (1100 o C) από το οξείδιο του αργιλίου (2050 o C). Και το οξείδιο του αλουμινίου είναι τέλεια διαλυτό σε λιωμένο κρυόλιθο.
Σε ένα διάλυμα κρυολίθου, το οξείδιο του αργιλίου διασπάται σε ιόντα:
Al 2 O 3 \u003d Al 3+ + AlO 3 3-
Στην κάθοδο Τα κατιόντα αλουμινίου μειώνονται:
Κάθοδος (-): Al 3+ + 3ē → Al 0
στην άνοδοοξειδώνονται αργιλικά ιόντα:
Άνοδος (+): 4AlO 3 3 – – 12ē → 2Al 2 O 3 + 3O 2 0
Η γενική εξίσωση για την ηλεκτρόλυση ενός διαλύματος οξειδίου του αργιλίου σε τήγμα κρυόλιθου είναι:
2Al 2 O 3 \u003d 4Al 0 + 3O 2 0
Στη βιομηχανία, στην ηλεκτρόλυση οξειδίου του αλουμινίου, χρησιμοποιούνται ράβδοι γραφίτη ως ηλεκτρόδια. Σε αυτή την περίπτωση, τα ηλεκτρόδια οξειδώνονται μερικώς (καίγονται) στο απελευθερωμένο οξυγόνο:
C0 + O 2 0 \u003d C +4 O 2 -2
Ηλεκτρόλυση με διαλυτά ηλεκτρόδια
Εάν το υλικό του ηλεκτροδίου είναι κατασκευασμένο από το ίδιο μέταλλο που υπάρχει στο διάλυμα με τη μορφή άλατος ή από ένα πιο ενεργό μέταλλο, τότε εκκένωση στην άνοδοόχι μόρια νερού ή ανιόντα, αλλά τα μεταλλικά σωματίδια οξειδώνονταιμέσα στο ηλεκτρόδιο.
Για παράδειγμα, θεωρήστε την ηλεκτρόλυση ενός διαλύματος θειικού χαλκού (II) με ηλεκτρόδια χαλκού.
Στην κάθοδοιόντα απορρίπτονται χαλκόςαπό λύση:
Κάθοδος (-): Cu 2+ + 2ē → Cu 0
στην άνοδο σωματίδια χαλκού οξειδώνονται ηλεκτρόδιο :
Άνοδος (+): Cu 0 – 2ē → Cu 2+
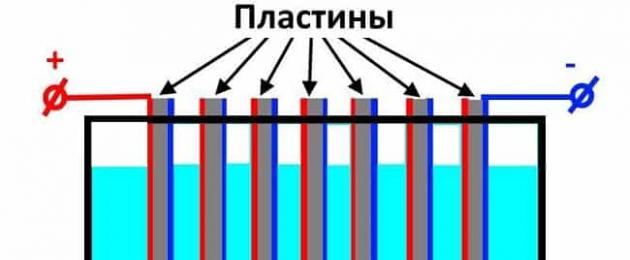
Εάν δύο ηλεκτρόδια χαμηλώσουν στον ηλεκτρολύτη και συνδεθούν σε μια πηγή ισχύος, τότε τα αρνητικά φορτισμένα ιόντα (ανιόντα) στον ηλεκτρολύτη θα αρχίσουν να έλκονται από το θετικό ηλεκτρόδιο (άνοδος) και τα θετικά φορτισμένα ιόντα (κατιόντα) στο αρνητικό ηλεκτρόδιο ( κάθοδος) - θα υπάρχει συνεχές ρεύμα στο κύκλωμα.
Τα κατιόντα, έχοντας φτάσει στην επιφάνεια της καθόδου, θα προσκολλήσουν μεταλλικά ηλεκτρόνια στον εαυτό τους (ανακτούν). Τα ανιόντα στην άνοδο θα δωρίσουν τα ηλεκτρόνια τους (οξειδώνονται).
Το παραπάνω σχήμα δείχνει την απλούστερη περίπτωση ηλεκτρόλυσης - στο τήγμα, το χλωριούχο νάτριο διασπάται σε κατιόντα νατρίου και ανιόντα χλωρίου. Υπό τη δράση ηλεκτρικού ρεύματος, το Na + ανάγεται στην κάθοδο, το Cl - - οξειδώνεται στην άνοδο.
Η εξίσωση της ηλεκτρόλυσης θα μοιάζει με αυτό:
2Na + +Cl - \u003d 2Na 0 +Cl 2 0 2NaCl \u003d 2Na + Cl
Ως αποτέλεσμα της ηλεκτρόλυσης, το αέριο χλώριο θα απελευθερωθεί στην άνοδο και το μεταλλικό νάτριο θα απελευθερωθεί στην κάθοδο.
Η αντίδραση οξειδοαναγωγής που συμβαίνει κατά την ηλεκτρόλυση προχωρά λόγω ηλεκτρικής ενέργειας - χωρίς εξωτερική πηγή ενέργειας, θα είναι αδύνατη.
Πρέπει να σημειωθεί ότι η ηλεκτρόλυση λύσηηλεκτρολύτης και ηλεκτρόλυση σε τήκωΟι ηλεκτρολύτες είναι ελαφρώς διαφορετικά πράγματα.
Η απόχρωση είναι ότι στο υδατικό διάλυμα του ηλεκτρολύτη, εκτός από ιόντα μετάλλων και υπολείμματα οξέος, υπάρχουν και προϊόντα διάστασης νερού, τα οποία πρέπει να ληφθούν υπόψη.
Κανόνες ηλεκτρόλυσης υδατικών διαλυμάτων
- Ηλεκτρόλυση στην κάθοδοεξαρτάται μόνο από θέσεις του μετάλλου στην ηλεκτροχημική σειρά τάσεων:
- εάν το κατιόν του ηλεκτρολύτη βρίσκεται στα αριστερά του αλουμινίου (συμπεριλαμβανομένου), το νερό ανάγεται στην κάθοδο με έκλυση υδρογόνου και τα μεταλλικά κατιόντα παραμένουν σε διάλυμα:
2H 2 O + 2e - \u003d H 2 + 2OH - (Li ... Al) - Εάν το κατιόν του ηλεκτρολύτη είναι μεταξύ αλουμινίου και υδρογόνου, τόσο το νερό όσο και τα κατιόντα μετάλλου ανάγεται στην κάθοδο.
Me n+ +ne - = Me 0 ; 2H 2 O + 2e - \u003d H 2 + 2OH - (Mn ... Pb) - Εάν το κατιόν του ηλεκτρολύτη βρίσκεται στα δεξιά του υδρογόνου, μόνο τα μεταλλικά κατιόντα ανάγεται στην κάθοδο:
Me n+ +ne - = Me 0 (Cu...Au) - αν υπάρχουν πολλά μέταλλα στο διάλυμα του ηλεκτρολύτη, τα κατιόντα του μετάλλου που είναι δεξιά από τα άλλα στη σειρά των τάσεων είναι τα πρώτα που αποκαθίστανται.
- εάν το κατιόν του ηλεκτρολύτη βρίσκεται στα αριστερά του αλουμινίου (συμπεριλαμβανομένου), το νερό ανάγεται στην κάθοδο με έκλυση υδρογόνου και τα μεταλλικά κατιόντα παραμένουν σε διάλυμα:
- Ηλεκτρόλυση στην άνοδοεξαρτάται μόνο από υλικόαπό την οποία κατασκευάζεται η άνοδος:
- στην περίπτωση μιας διαλυτής ανόδου (μέταλλα που οξειδώνονται κατά την ηλεκτρόλυση - σίδηρος, χαλκός, ψευδάργυρος, άργυρος) - το μέταλλο της ανόδου είναι πάντα οξειδωμένο:
Me 0 -ne - = Me n+ - στην περίπτωση μιας αδιάλυτης ανόδου (χρυσός, πλατίνα, γραφίτης):
- η διαδικασία οξείδωσης ανιόντων συμβαίνει κατά την ηλεκτρόλυση διαλυμάτων αλάτων οξέων χωρίς οξυγόνο, με εξαίρεση τα φθοριούχα:
Ac m - me - = Ac 0 - υπάρχει μια διαδικασία οξείδωσης του νερού σε άλλες περιπτώσεις (ηλεκτρόλυση υδροξυοξέων και φθοριδίων) - το ανιόν παραμένει σε διάλυμα:
2H 2 O-4e - \u003d 4H + + O 2 - κατά την ηλεκτρόλυση των αλκαλικών διαλυμάτων, τα ιόντα υδροξειδίου οξειδώνονται:
4OH - -4e - \u003d 2H 2 O + O 2
- η διαδικασία οξείδωσης ανιόντων συμβαίνει κατά την ηλεκτρόλυση διαλυμάτων αλάτων οξέων χωρίς οξυγόνο, με εξαίρεση τα φθοριούχα:
- η αναγωγική δραστηριότητα των ανιόντων μειώνεται στη σειρά (ανάλογα αυξάνεται η ικανότητα οξείδωσης): I - ; Br-; S2-; Cl-; OH-; SO 4 2- ; NO 3 - ; ΦΑ-
- στην περίπτωση μιας διαλυτής ανόδου (μέταλλα που οξειδώνονται κατά την ηλεκτρόλυση - σίδηρος, χαλκός, ψευδάργυρος, άργυρος) - το μέταλλο της ανόδου είναι πάντα οξειδωμένο:
Βιομηχανική εφαρμογή ηλεκτρόλυσης
- Απομόνωση και καθαρισμός μετάλλων.
- Λήψη αλουμινίου, μαγνησίου, νατρίου, καδμίου.
- Λήψη αλκαλίων, χλωρίου, υδρογόνου.
- Καθαρισμός χαλκού, νικελίου, μολύβδου.
- Διαδικασίες ψεκασμού προστατευτικών επιστρώσεων για την προστασία των μετάλλων από τη διάβρωση.
Παραδείγματα επίλυσης προβλημάτων ηλεκτρόλυσης
1. Γράψτε μια εξίσωση για την ηλεκτρόλυση διαλύματος χλωριούχου καλίου για αδιάλυτη άνοδο.
- KCl → K + +Cl -
- ηλεκτρόλυση στην άνοδο (+):
2Cl - -2e - \u003d Cl 2 0 - ηλεκτρόλυση στην κάθοδο (-):
2H 2 O + 2e - \u003d H 2 + 2OH - - Ολική ιοντική εξίσωση:
2H 2 O + 2Cl - \u003d H 2 + Cl 2 + 2OH - - Μοριακή εξίσωση:
2KCl + 2H 2 O \u003d H 2 + Cl 2 + 2KOH
2. Γράψτε μια εξίσωση για την ηλεκτρόλυση διαλύματος χλωριούχου καλίου για χαλκό (διαλυτή) άνοδο.
- KCl → K + +Cl -
- άνοδος(+):
Cu 0 -2e - = Cu 2+ - Τα ιόντα χαλκού κατά τη διαδικασία της ηλεκτρόλυσης περνούν από την άνοδο στην κάθοδο (απομόνωση καθαρού χαλκού στην κάθοδο):
Cu 2+ +2e - = Cu 0 - Η συγκέντρωση του χλωριούχου καλίου στο διάλυμα παραμένει σταθερή, επομένως, η ολική εξίσωση ηλεκτρόλυσης για τη διαλυτή άνοδο δεν μπορεί να γραφτεί.
3. Γράψτε μια εξίσωση για την ηλεκτρόλυση διαλύματος υδροξειδίου του νατρίου.
- NaOH → Na + +OH -
- ηλεκτρόλυση στην άνοδο(+):
4OH - + 4e - \u003d O 2 + 2H 2 O - ηλεκτρόλυση στην κάθοδο(-):
2H 2 O + 2e - \u003d H 2 + 2OH - - Συνοπτικές εξισώσεις:
4H 2 O + 4OH - \u003d 2H 2 + O 2 + 4OH - + 2H 2 O
2H 2 O \u003d 2H 2 + O 2
4. Γράψτε μια εξίσωση για την ηλεκτρόλυση διαλύματος χλωριούχου ψευδαργύρου με ηλεκτρόδια άνθρακα.
- ZnCl 2 → Zn 2+ +2Cl -
- ηλεκτρόλυση στην άνοδο(+):
2Cl - -2e - \u003d Cl 2 - κάθοδος(-):
Zn 2+ +2e - = Zn 0
2H 2 O + 2e - \u003d H 2 + 2OH - - Η συνολική εξίσωση της ηλεκτρόλυσης δεν μπορεί να γραφτεί, αφού δεν είναι γνωστό πόσο ηλεκτρικό ρεύμα δαπανάται για τη μείωση του νερού και πόσο δαπανάται για την αναγωγή των ιόντων ψευδαργύρου.
5. Να γράψετε μια εξίσωση για την ηλεκτρόλυση υδατικού διαλύματος χαλκού (II) και νιτρικών αργύρου με αδιάλυτα ηλεκτρόδια.
- Cu(NO 3) 2 → Cu 2+ + 2NO 3 -
AgNO 3 → Ag + + NO 3 - - ηλεκτρόλυση στην άνοδο(+):
2H 2 O-4e - \u003d O 2 + 4H + - ηλεκτρόλυση στην κάθοδο(-):
Cu 2+ +2e - = Cu 0
Ag + +e - = Ag 0 - Σύμφωνα με τη θέση των μετάλλων στη σειρά τάσης (βλ. παραπάνω), τα κατιόντα αργύρου θα μειωθούν πρώτα, τα κατιόντα χαλκού - τελευταία.
- Ιωνικές εξισώσεις:
4Ag + +2H 2 O \u003d 4Ag 0 + O 2 + 4H +
2Cu 2+ +2H 2 O \u003d 2Cu 0 + O 2 + 4H + - Μοριακές εξισώσεις:
4AgNO 3 + 2H 2 O \u003d 4Ag + O 2 + 4HNO 3
2Cu (NO 3) 2 + 2H 2 O \u003d 2Cu + O 2 + 4HNO 3
Ηλεκτρόλυση
Οι διεργασίες που συμβαίνουν κατά την ηλεκτρόλυση είναι αντίθετες με τις διεργασίες που συμβαίνουν κατά τη λειτουργία ενός γαλβανικού στοιχείου. Εάν, κατά τη λειτουργία ενός γαλβανικού στοιχείου, η ενέργεια μιας αυθόρμητης οξειδοαναγωγικής αντίδρασης μετατρέπεται σε ηλεκτρική ενέργεια, τότε κατά τη διάρκεια της ηλεκτρόλυσης, συμβαίνει μια χημική αντίδραση λόγω της ενέργειας ενός ηλεκτρικού ρεύματος.
Η ηλεκτρόλυση είναι μια διεργασία οξειδοαναγωγής που συμβαίνει στα ηλεκτρόδια όταν ένα ηλεκτρικό ρεύμα διέρχεται από ένα διάλυμα ηλεκτρολύτη ή τήγμα.
Η ηλεκτρόλυση πραγματοποιείται σε ηλεκτρολύτες, τα κύρια συστατικά των οποίων είναι δύο ηλεκτρόδια βυθισμένα σε έναν ιοντικό αγωγό (ηλεκτρολύτη) και συνδεδεμένα με τους ακροδέκτες μιας πηγής συνεχούς ρεύματος.
Ένα ηλεκτρόδιο που συνδέεται με τον αρνητικό πόλο μιας πηγής ρεύματος ονομάζεται κάθοδος,και με θετικό άνοδος.
Όταν εφαρμόζεται τάση, συμβαίνουν διεργασίες αναγωγής στην κάθοδο και διεργασίες οξείδωσης στην άνοδο.
Οι άνοδοι είναι αδιάλυτες (από άνθρακα, γραφίτη, πλατίνα και ιρίδιο) και διαλυτές (από χαλκό, άργυρο, ψευδάργυρο, κάδμιο και νικέλιο). Η διαλυτή άνοδος υφίσταται οξείδωση, δηλ. στέλνει ηλεκτρόνια σε εξωτερικό κύκλωμα.
Η ηλεκτρόλυση του τήγματος προχωρά σύμφωνα με το ακόλουθο σχήμα:
1. ανιόντα που σχηματίζονται κατά την τήξη του ηλεκτρολύτη με αύξουσα σειρά των δυναμικών ηλεκτροδίων τους (j 0)
2. Τα κατιόντα ανάγονται στην κάθοδο με φθίνουσα σειρά του j 0 .
Για παράδειγμα, 2NaCl ® 2Na + Cl 2 K (-) 2Na + + 2e = 2Na 0
λιώστε A (+) 2Cl - - 2e \u003d Cl 2
Κατά τον προσδιορισμό των προϊόντων ηλεκτρόλυσης υδατικών διαλυμάτων ηλεκτρολυτών, είναι απαραίτητο να λαμβάνεται υπόψη η δυνατότητα συμμετοχής σε αντιδράσεις οξειδοαναγωγής των μορίων νερού, το υλικό από το οποίο κατασκευάζεται η άνοδος, η φύση των ιόντων και οι συνθήκες ηλεκτρόλυσης.
Πίνακας 3 - Γενικοί κανόνες για τη συγγραφή εξισώσεων ηλεκτρόλυσης
υδατικά διαλύματα ηλεκτρολυτών
1. Ηλεκτρόλυση διαλύματος NaCl (αδρανής ανόδου)
K (-): Na + ; H2O
H 2 O + 2e ® H 2 + 2OH -
A (+): Cl - ; H2O
2 Cl - - 2e ® Cl2
2H2O +2NaCl ΗΛΕΚΤΡΟΝΙΚΗ ΔΙΕΥΘΥΝΣΗ ρεύμα H2 + Cl 2 + 2NaOH
Ως αποτέλεσμα, το H 2 απελευθερώνεται στην κάθοδο, το Cl 2 στην άνοδο και το NaOH συσσωρεύεται στον χώρο της καθόδου του ηλεκτρολύτη
2. Ηλεκτρόλυση διαλύματος ZnSO 4 (αδρανής ανόδου)
K (-): Zn 2+ ; H2O
Zn 2+ + 2e ® Zn 0
2H 2 O + 2e ® H 2 + 2OH -
Α (+): 2Η2Ο - 4ε® Ο2 + 4Η+
Zn 2+ +4H 2 O ® Zn + H 2 + O 2 + 2OH - + 4H +
Αφού μειώσουμε τα μόρια H 2 O και προσθέσουμε ιόντα SO 4 2- και στις δύο πλευρές της εξίσωσης, παίρνουμε την εξίσωση μοριακής ηλεκτρόλυσης:
ZnSO 4 + 2H 2 O ΗΛΕΚΤΡΟΝΙΚΗ ΔΙΕΥΘΥΝΣΗ ρεύμα Zn + H 2 + O 2 + H 2 SO 4
3. Ηλεκτρόλυση διαλύματος K 2 SO 4 (αδρανής ανόδου)
K (-): K + ; H2O
H 2 O + 2e ® H 2 + 2OH -
A (+): SO 4 2-; H2O
2H 2 O - 4e ® O 2 + 4H +
2H 2 O + 2e ΗΛΕΚΤΡΟΝΙΚΗ ΔΙΕΥΘΥΝΣΗ ρεύμα O 2 + 2H 2
εκείνοι. Η ηλεκτρόλυση ενός διαλύματος θειικού καλίου ανάγεται στην αποσύνθεση του νερού. Η συγκέντρωση του αλατιού στο διάλυμα αυξάνεται.
4. Ηλεκτρόλυση διαλύματος ZnSO 4 με άνοδο ψευδαργύρου.
K (-): Zn 2+ ; H2O
Zn 2+ + 2e ® Zn 0
2H 2 O + 2e ® H 2 + 2OH -
A (+) : Zn 0 ; H2O
Zn 0 -2e ® Zn 2+
Zn 0 + Zn 2+ ® Zn 2+ + Zn 0
Εκείνοι. Η ηλεκτρόλυση ενός διαλύματος ZnSO 4 με άνοδο ψευδαργύρου ανάγεται στη μεταφορά ψευδαργύρου από την άνοδο στην κάθοδο.
Μεταξύ της ποσότητας της ουσίας που απελευθερώνεται στα ηλεκτρόδια κατά την ηλεκτρόλυση, της ποσότητας ηλεκτρικής ενέργειας που διέρχεται από το διάλυμα και του χρόνου ηλεκτρόλυσης, υπάρχουν εξαρτήσεις που εκφράζονται από το νόμο του Faraday.
Ο πρώτος νόμος του Faraday: η μάζα μιας ουσίας που απελευθερώνεται ή διαλύεται στα ηλεκτρόδια είναι ευθέως ανάλογη με την ποσότητα ηλεκτρικής ενέργειας που διέρχεται από το διάλυμα:
m = --------- ; όπου m είναι η μάζα της ουσίας που απελευθερώνεται στα ηλεκτρόδια,
FM E - μοριακή μάζα του ισοδύναμου μιας ουσίας, g / mol,
I - ρεύμα ρεύματος, A;
t - χρόνος ηλεκτρόλυσης, δευτ.
Η F είναι η σταθερά του Faraday (96500 C/mol).
Ο δεύτερος νόμος του Faraday: για μια ορισμένη ποσότητα ηλεκτρικής ενέργειας που διέρχεται από ένα διάλυμα, η αναλογία των μαζών των αντιδρώντων ουσιών είναι ίση με την αναλογία των μοριακών μαζών των χημικών τους ισοδυνάμων:
Κωνστ
ΕΓΩ 1 ΜΕ 2 ΕΓΩ 3
Για να απελευθερωθεί ή να διαλυθεί 1 γραμμομοριακό ισοδύναμο οποιασδήποτε ουσίας, είναι απαραίτητο να περάσει η ίδια ποσότητα ηλεκτρισμού, ίση με 96.500 C, μέσω ενός διαλύματος ή τήγματος. Αυτή η τιμή ονομάζεται Σταθερά Faraday.
Η ποσότητα της ουσίας που απελευθερώνεται στο ηλεκτρόδιο κατά τη διέλευση 1 C ηλεκτρικής ενέργειας ονομάζεται της ηλεκτροχημικό ισοδύναμο (ε ).
ε = . ------- , όπου ε - ηλεκτροχημική
F ισοδύναμο
Me - ισοδύναμο μοριακής μάζας
στοιχείο (ουσία); , g/mol
F είναι η σταθερά Faraday, C/mol.
Πίνακας 4 - Ηλεκτροχημικά ισοδύναμα ορισμένων στοιχείων
| κατιόν | Εγώ, g/mol | ε, mg | Ανιόν | Εγώ, g/mol | ε, mg |
| Ag + Al 3+ Au3+ Ba 2+ Ca 2+ Cd 2+ Cr 3+ Cu 2+ Fe 2+ Fe 3+ H + K + Li + Mg 2+ Mn 2+ Na + Ni 2+ Pb 2+ Sn 2+ Sr2+ Zn2+ | 107,88 8,99 65,70 58,70 20,04 56,20 17,34 31,77 27,92 18,61 1,008 39,10 6,94 12,16 27,47 22,90 29,34 103,60 59,40 43,80 32,69 | 1,118 0,93 0,681 0,712 0,208 0,582 0,179 0,329 0,289 0,193 0,0105 0,405 0,072 0,126 0,285 0,238 0,304 1,074 0,616 0,454 0,339 | Br - BrO 3 - Cl - ClO 3 - HCOO - CH 3 COO - CN - CO 3 2- C 2 O 4 2- CrO 4 2- F - I - NO 3 - IO 3 - OH - S 2 - SO 4 2 -Se 2- SiO 3 2- | 79,92 127,92 35,46 83,46 45,01 59,02 26,01 30,00 44,50 58,01 19,00 126,42 174,92 62,01 17,00 16,03 48,03 39,50 38,03 | 0,828 1,326 0,368 0,865 0,466 0,612 0,270 0,311 0,456 0,601 0,197 1,315 1,813 0,643 0,177 0,170 0,499 0,411 0,395 |
Οι διαδικασίες οξείδωσης και αναγωγής αποτελούν τη βάση της λειτουργίας τέτοιων χημικών πηγών ενέργειας όπως οι μπαταρίες.
Οι μπαταρίες ονομάζονται γαλβανικές κυψέλες στις οποίες είναι δυνατές αναστρέψιμες διαδικασίες φόρτισης και εκφόρτισης, οι οποίες εκτελούνται χωρίς την προσθήκη ουσιών που εμπλέκονται στην εργασία τους.
Για την αποκατάσταση της χρησιμοποιημένης χημικής ενέργειας, η μπαταρία φορτίζεται περνώντας ρεύμα από εξωτερική πηγή. Ταυτόχρονα, σημειώνονται ηλεκτροχημικές αντιδράσεις στα ηλεκτρόδια, οι οποίες είναι αντίθετες από αυτές που έγιναν όταν η μπαταρία χρησιμοποιήθηκε ως πηγή ρεύματος.
Οι μπαταρίες μολύβδου-οξέος είναι σήμερα οι πιο συνηθισμένες, στις οποίες το διοξείδιο του μολύβδου PbO 2 χρησιμεύει ως θετικό ηλεκτρόδιο και το μεταλλικό μόλυβδο Pb ως αρνητικό ηλεκτρόδιο.
Ένα διάλυμα 25-30% θειικού οξέος χρησιμοποιείται ως ηλεκτρολύτης, επομένως οι μπαταρίες μολύβδου-οξέος ονομάζονται επίσης όξινες.
Οι διαδικασίες που συμβαίνουν κατά την εκφόρτιση και τη φόρτιση της μπαταρίας μπορούν να συνοψιστούν ως εξής:
Pb 0 + Pb +4 O 2 + 4Н + + 2SO 4 2- « 2Pb 0 + 2SO 4 2- + 2H 2 O
Εκτός από την μπαταρία μολύβδου, στην πράξη χρησιμοποιούνται αλκαλικές μπαταρίες: νικέλιο-κάδμιο, νικέλιο-σίδερο.
Πίνακας 5 - Τύποι μπαταριών
Η ηλεκτρόλυση χρησιμοποιείται ευρέως στον κατασκευαστικό τομέα, για παράδειγμα, για την παραγωγή αλουμινίου (μηχανές ψημένης ανόδου RA-300, RA-400, RA-550, κ.λπ.) ή χλωρίου (βιομηχανικές εγκαταστάσεις Asahi Kasei). Στην καθημερινή ζωή, αυτή η ηλεκτροχημική διαδικασία χρησιμοποιήθηκε πολύ λιγότερο συχνά, όπως ο ηλεκτροσυγκολλητής Intellichlor pool ή ο συγκολλητής πλάσματος Star 7000. Η αύξηση του κόστους καυσίμου, των τιμολογίων αερίου και της θέρμανσης άλλαξε ριζικά την κατάσταση, κάνοντας την ιδέα της ηλεκτρόλυσης νερού στο σπίτι δημοφιλές. Σκεφτείτε ποιες είναι οι συσκευές για τη διάσπαση του νερού (ηλεκτρολυτές) και ποιος είναι ο σχεδιασμός τους, καθώς και πώς να φτιάξετε μια απλή συσκευή με τα χέρια σας.
Τι είναι ο ηλεκτρολύτης, τα χαρακτηριστικά και η εφαρμογή του
Αυτό είναι το όνομα μιας συσκευής για την ομώνυμη ηλεκτροχημική διαδικασία, η οποία απαιτεί εξωτερική πηγή ενέργειας. Δομικά, αυτή η συσκευή είναι ένα λουτρό γεμάτο με ηλεκτρολύτη, στο οποίο τοποθετούνται δύο ή περισσότερα ηλεκτρόδια.
Το κύριο χαρακτηριστικό τέτοιων συσκευών είναι η παραγωγικότητα, συχνά αυτή η παράμετρος υποδεικνύεται στο όνομα του μοντέλου, για παράδειγμα, σε σταθερές εγκαταστάσεις ηλεκτρόλυσης SEU-10, SEU-20, SEU-40, MBE-125 (ηλεκτρολυτές μπλοκ μεμβρανών) κ.λπ. . Σε αυτές τις περιπτώσεις, τα στοιχεία δείχνουν την παραγωγή υδρογόνου (m 3 /h).
Όσον αφορά τα υπόλοιπα χαρακτηριστικά, εξαρτώνται από τον συγκεκριμένο τύπο συσκευής και το πεδίο εφαρμογής, για παράδειγμα, όταν πραγματοποιείται ηλεκτρόλυση νερού, οι ακόλουθες παράμετροι επηρεάζουν την απόδοση της εγκατάστασης:

Έτσι, εφαρμόζοντας 14 βολτ στις εξόδους, θα πάρουμε 2 βολτ σε κάθε στοιχείο, ενώ οι πλάκες σε κάθε πλευρά θα έχουν διαφορετικά δυναμικά. Οι ηλεκτρολύτες που χρησιμοποιούν παρόμοιο σύστημα σύνδεσης πλακών ονομάζονται ξηροί ηλεκτρολύτες.
- Η απόσταση μεταξύ των πλακών (μεταξύ του χώρου καθόδου και ανόδου), όσο μικρότερη είναι, τόσο λιγότερη αντίσταση θα υπάρχει και, επομένως, περισσότερο ρεύμα θα περάσει από το διάλυμα ηλεκτρολύτη, γεγονός που θα οδηγήσει σε αύξηση της παραγωγής αερίου.
- Οι διαστάσεις της πλάκας (που σημαίνει την περιοχή των ηλεκτροδίων) είναι ευθέως ανάλογες με το ρεύμα που διαρρέει τον ηλεκτρολύτη, πράγμα που σημαίνει ότι επηρεάζουν επίσης την απόδοση.
- Συγκέντρωση ηλεκτρολυτών και θερμική ισορροπία του.
- Χαρακτηριστικά του υλικού που χρησιμοποιείται για την κατασκευή των ηλεκτροδίων (ο χρυσός είναι ιδανικό υλικό, αλλά πολύ ακριβό, επομένως ο ανοξείδωτος χάλυβας χρησιμοποιείται σε σπιτικά κυκλώματα).
- Εφαρμογή καταλυτών διεργασίας κ.λπ.
Όπως αναφέρθηκε παραπάνω, φυτά αυτού του τύπου μπορούν να χρησιμοποιηθούν ως γεννήτριες υδρογόνου, για την παραγωγή χλωρίου, αλουμινίου ή άλλων ουσιών. Χρησιμοποιούνται επίσης ως συσκευές καθαρισμού και απολύμανσης νερού (UPEV, VGE), καθώς και ως συγκριτική ανάλυση της ποιότητάς του (Tesp 001).

Μας ενδιαφέρουν πρωτίστως οι συσκευές που παράγουν αέριο Brown (υδρογόνο με οξυγόνο), καθώς αυτό το μείγμα έχει όλες τις προοπτικές χρήσης ως εναλλακτικός φορέας ενέργειας ή πρόσθετο καυσίμου. Θα τα εξετάσουμε λίγο αργότερα, αλλά προς το παρόν ας περάσουμε στο σχεδιασμό και την αρχή λειτουργίας του απλούστερου ηλεκτρολύτη που χωρίζει το νερό σε υδρογόνο και οξυγόνο.
Συσκευή και λεπτομερής αρχή λειτουργίας
Συσκευή παραγωγής εκρηκτικού αερίου, για λόγους ασφαλείας, δεν συνεπάγεται τη συσσώρευσή του, δηλαδή το μείγμα αερίου καίγεται αμέσως μετά την παραλαβή του. Αυτό απλοποιεί κάπως τον σχεδιασμό. Στην προηγούμενη ενότητα, εξετάσαμε τα κύρια κριτήρια που επηρεάζουν την απόδοση της συσκευής και επιβάλλουν ορισμένες απαιτήσεις απόδοσης.
Η αρχή λειτουργίας της συσκευής φαίνεται στο σχήμα 4, μια πηγή σταθερής τάσης συνδέεται με ηλεκτρόδια βυθισμένα σε διάλυμα ηλεκτρολύτη. Ως αποτέλεσμα, ένα ρεύμα αρχίζει να διέρχεται από αυτό, η τάση του οποίου είναι υψηλότερη από το σημείο αποσύνθεσης των μορίων του νερού.
 Εικόνα 4. Ο σχεδιασμός ενός απλού κελιού
Εικόνα 4. Ο σχεδιασμός ενός απλού κελιού Ως αποτέλεσμα αυτής της ηλεκτροχημικής διαδικασίας, η κάθοδος απελευθερώνει υδρογόνο και η άνοδος απελευθερώνει οξυγόνο, σε αναλογία 2 προς 1.
Τύποι ηλεκτρολυτών
Ας ρίξουμε μια σύντομη ματιά στα χαρακτηριστικά σχεδιασμού των κύριων τύπων συσκευών διαχωρισμού νερού.
Στεγνός
Ο σχεδιασμός μιας συσκευής αυτού του τύπου φαίνεται στο Σχήμα 2, το χαρακτηριστικό της είναι ότι με το χειρισμό του αριθμού των κυψελών, είναι δυνατό να τροφοδοτηθεί η συσκευή από μια πηγή με τάση που υπερβαίνει σημαντικά το ελάχιστο δυναμικό ηλεκτροδίου.
Ρεύση
Μια απλοποιημένη διάταξη συσκευών αυτού του τύπου μπορεί να βρεθεί στο Σχήμα 5. Όπως μπορείτε να δείτε, ο σχεδιασμός περιλαμβάνει ένα λουτρό με ηλεκτρόδια "Α", πλήρως γεμάτο με ένα διάλυμα και μια δεξαμενή "D".
 Εικόνα 5. Κατασκευή κυψέλης ροής
Εικόνα 5. Κατασκευή κυψέλης ροής Η αρχή λειτουργίας της συσκευής είναι η εξής:
- Στην είσοδο της ηλεκτροχημικής διεργασίας, το αέριο, μαζί με τον ηλεκτρολύτη, συμπιέζεται έξω στο δοχείο "D" μέσω του σωλήνα "Β".
- στη δεξαμενή "D" υπάρχει διαχωρισμός από το διάλυμα ηλεκτρολύτη του αερίου, το οποίο εκκενώνεται μέσω της βαλβίδας εξόδου "C".
- ο ηλεκτρολύτης επιστρέφει στο λουτρό υδρόλυσης μέσω του σωλήνα "Ε".
Μεμβράνη
Το κύριο χαρακτηριστικό των συσκευών αυτού του τύπου είναι η χρήση ενός στερεού ηλεκτρολύτη (μεμβράνη) που βασίζεται σε ένα πολυμερές. Ο σχεδιασμός συσκευών αυτού του τύπου φαίνεται στο σχήμα 6.
 Εικόνα 6. Ηλεκτρολυτής τύπου μεμβράνης
Εικόνα 6. Ηλεκτρολυτής τύπου μεμβράνης Το κύριο χαρακτηριστικό τέτοιων συσκευών είναι ο διπλός σκοπός της μεμβράνης· όχι μόνο μεταφέρει πρωτόνια και ιόντα, αλλά επίσης διαχωρίζει τόσο τα ηλεκτρόδια όσο και τα προϊόντα της ηλεκτροχημικής διαδικασίας σε φυσικό επίπεδο.
Διάφραγμα
Σε περιπτώσεις που δεν επιτρέπεται η διάχυση προϊόντων ηλεκτρόλυσης μεταξύ των θαλάμων ηλεκτροδίων, χρησιμοποιείται ένα πορώδες διάφραγμα (που έδωσε το όνομα σε τέτοιες συσκευές). Το υλικό για αυτό μπορεί να είναι κεραμικό, αμίαντος ή γυαλί. Σε ορισμένες περιπτώσεις, ίνες πολυμερούς ή υαλοβάμβακας μπορούν να χρησιμοποιηθούν για τη δημιουργία ενός τέτοιου διαφράγματος. Το σχήμα 7 δείχνει η απλούστερη επιλογήσυσκευή διαφράγματος για ηλεκτροχημικές διεργασίες.

Εξήγηση:
- έξοδος για οξυγόνο.
- Φιάλη σε σχήμα U.
- Έξοδος για υδρογόνο.
- Ανοδος.
- Κάθοδος.
- Διάφραγμα.
αλκαλική
Η ηλεκτροχημική διεργασία δεν είναι δυνατή σε απεσταγμένο νερό· ως καταλύτης χρησιμοποιείται ένα συμπυκνωμένο αλκαλικό διάλυμα (η χρήση αλατιού είναι ανεπιθύμητη, καθώς απελευθερώνεται χλώριο). Με βάση αυτό, οι περισσότερες ηλεκτροχημικές συσκευές για τη διάσπαση νερού μπορούν να ονομαστούν αλκαλικές.
Σε θεματικά φόρουμ, συνιστάται η χρήση υδροξειδίου του νατρίου (NaOH), το οποίο, σε αντίθεση με τη μαγειρική σόδα (NaHCO 3), δεν διαβρώνει το ηλεκτρόδιο. Σημειώστε ότι το τελευταίο έχει δύο σημαντικά πλεονεκτήματα:
- Μπορείτε να χρησιμοποιήσετε ηλεκτρόδια σιδήρου.
- Δεν εκπέμπονται επιβλαβείς ουσίες.
Όμως, ένα σημαντικό μειονέκτημα αναιρεί όλα τα πλεονεκτήματα της μαγειρικής σόδας ως καταλύτη. Η συγκέντρωσή του στο νερό δεν είναι μεγαλύτερη από 80 γραμμάρια ανά λίτρο. Αυτό μειώνει την αντίσταση του ηλεκτρολύτη στον παγετό και την τρέχουσα αγωγιμότητα του. Εάν το πρώτο μπορεί ακόμα να γίνει ανεκτή στη ζεστή εποχή, το δεύτερο απαιτεί αύξηση της επιφάνειας των πλακών ηλεκτροδίων, γεγονός που με τη σειρά του αυξάνει το μέγεθος της δομής.
Ηλεκτρολύτης για παραγωγή υδρογόνου: σχέδια, διάγραμμα
Σκεφτείτε πώς μπορείτε να φτιάξετε έναν ισχυρό καυστήρα αερίου που τροφοδοτείται από ένα μείγμα υδρογόνου και οξυγόνου. Ένα διάγραμμα μιας τέτοιας συσκευής φαίνεται στο Σχήμα 8.
 Ρύζι. 8. Συσκευή καυστήρα υδρογόνου
Ρύζι. 8. Συσκευή καυστήρα υδρογόνου Εξήγηση:
- Ακροφύσιο καυστήρα.
- σωλήνες από καουτσούκ.
- Δεύτερη κλειδαριά νερού.
- Πρώτη κλειδαριά νερού.
- Ανοδος.
- Κάθοδος.
- Ηλεκτρόδια.
- Μπάνιο με ηλεκτρολύτη.
Το σχήμα 9 δείχνει ένα σχηματικό διάγραμμα της τροφοδοσίας του ηλεκτρολύτη του καυστήρα μας.
 Ρύζι. 9. Τροφοδοτικό καυστήρα ηλεκτρόλυσης
Ρύζι. 9. Τροφοδοτικό καυστήρα ηλεκτρόλυσης Για έναν ισχυρό ανορθωτή, χρειαζόμαστε τα ακόλουθα εξαρτήματα:
- Τρανζίστορ: VT1 - MP26B; VT2 - P308.
- Θυρίστορ: VS1 - KU202N.
- Δίοδοι: VD1-VD4 - D232; VD5 - D226B; VD6, VD7 - D814B.
- Πυκνωτές: 0,5uF.
- Μεταβλητές αντιστάσεις: R3 -22 kOhm.
- Αντιστάσεις: R1 - 30 kOhm; R2 - 15 kOhm; R4 - 800 Ohm; R5 - 2,7 kOhm; R6 - 3 kOhm; R7 - 10 kOhm.
- PA1 - αμπερόμετρο με κλίμακα μέτρησης τουλάχιστον 20 A.
Μια σύντομη οδηγία για τις λεπτομέρειες του ηλεκτρολύτη.
Ένα μπάνιο μπορεί να γίνει από μια παλιά μπαταρία. Οι πλάκες πρέπει να κοπούν 150x150 mm από σίδερο στέγης (πάχος φύλλου 0,5 mm). Για να εργαστείτε με το παραπάνω τροφοδοτικό, θα χρειαστεί να συναρμολογήσετε έναν ηλεκτρολύτη για 81 κύτταρα. Το σχέδιο σύμφωνα με το οποίο πραγματοποιείται η εγκατάσταση φαίνεται στο Σχήμα 10.
 Ρύζι. 10. Σχέδιο ηλεκτρόλυσης καυστήρα υδρογόνου
Ρύζι. 10. Σχέδιο ηλεκτρόλυσης καυστήρα υδρογόνου Σημειώστε ότι η συντήρηση και η διαχείριση μιας τέτοιας συσκευής δεν προκαλεί δυσκολίες.
Φτιάξτο μόνος σου ηλεκτρόλυση για αυτοκίνητο
Στο Διαδίκτυο μπορείτε να βρείτε πολλά διαγράμματα συστημάτων HHO, τα οποία, σύμφωνα με τους συγγραφείς, σας επιτρέπουν να εξοικονομήσετε από 30% έως 50% των καυσίμων. Τέτοιοι ισχυρισμοί είναι υπερβολικά αισιόδοξοι και γενικά δεν υποστηρίζονται από κανένα στοιχείο. Ένα απλοποιημένο διάγραμμα ενός τέτοιου συστήματος φαίνεται στο Σχήμα 11.
 Απλοποιημένο διάγραμμα ηλεκτρολύτη για αυτοκίνητο
Απλοποιημένο διάγραμμα ηλεκτρολύτη για αυτοκίνητο Θεωρητικά, μια τέτοια συσκευή θα πρέπει να μειώνει την κατανάλωση καυσίμου λόγω της πλήρους εξάντλησής της. Για να γίνει αυτό, το μείγμα του Brown τροφοδοτείται στο φίλτρο αέρα του συστήματος καυσίμου. Αυτό είναι υδρογόνο και οξυγόνο που λαμβάνονται από μια συσκευή ηλεκτρόλυσης που τροφοδοτείται από το εσωτερικό δίκτυο του αυτοκινήτου, γεγονός που αυξάνει την κατανάλωση καυσίμου. Φαύλος κύκλος.
Φυσικά, μπορεί να χρησιμοποιηθεί ένα κύκλωμα ρυθμιστή ρεύματος PWM, ένα πιο αποτελεσματικό τροφοδοτικό μεταγωγής ή άλλα κόλπα για τη μείωση της κατανάλωσης ενέργειας. Μερικές φορές στο Διαδίκτυο υπάρχουν προσφορές για αγορά τροφοδοτικού χαμηλού αμπέρ για ηλεκτρολύτη, κάτι που είναι γενικά ανόητο, καθώς η απόδοση της διαδικασίας εξαρτάται άμεσα από την ισχύ του ρεύματος.
Είναι σαν το σύστημα Kuznetsov, του οποίου ο ενεργοποιητής νερού έχει χαθεί και δεν υπάρχει δίπλωμα ευρεσιτεχνίας κ.λπ. Στα παραπάνω βίντεο, όπου μιλούν για τα αναμφισβήτητα πλεονεκτήματα τέτοιων συστημάτων, πρακτικά δεν υπάρχουν αιτιολογημένα επιχειρήματα. Αυτό δεν σημαίνει ότι η ιδέα δεν έχει δικαίωμα ύπαρξης, αλλά οι διεκδικούμενες οικονομίες είναι «ελαφρώς» υπερβολικές.
Φτιάξτο μόνος σου ηλεκτρολύτης για θέρμανση σπιτιού
Η κατασκευή ενός οικιακού ηλεκτρολύτη για τη θέρμανση ενός σπιτιού αυτή τη στιγμή δεν έχει νόημα, καθώς το κόστος του υδρογόνου που λαμβάνεται με ηλεκτρόλυση είναι πολύ πιο ακριβό από το φυσικό αέριο ή άλλους φορείς θερμότητας.
Θα πρέπει επίσης να ληφθεί υπόψη ότι κανένα μέταλλο δεν μπορεί να αντέξει τη θερμοκρασία καύσης του υδρογόνου. Είναι αλήθεια ότι υπάρχει μια λύση που κατοχύρωσε ο Stan Martin που σας επιτρέπει να ξεπεράσετε αυτό το πρόβλημα. Είναι απαραίτητο να δώσετε προσοχή στο βασικό σημείο που σας επιτρέπει να διακρίνετε μια αξιόλογη ιδέα από την προφανή ανοησία. Η διαφορά μεταξύ τους είναι ότι στο πρώτο χορηγείται δίπλωμα ευρεσιτεχνίας και το δεύτερο βρίσκει τους υποστηρικτές του στο Διαδίκτυο.
Αυτό θα μπορούσε να είναι το τέλος του άρθρου για οικιακούς και βιομηχανικούς ηλεκτρολύτες, αλλά είναι λογικό να κάνουμε μια μικρή επισκόπηση των εταιρειών που παράγουν αυτές τις συσκευές.
Επισκόπηση των κατασκευαστών ηλεκτρολύτη
Παραθέτουμε κατασκευαστές που παράγουν κυψέλες καυσίμου με βάση ηλεκτρολύτες, ορισμένες εταιρείες παράγουν επίσης οικιακές συσκευές: NEL Hydrogen (Νορβηγία, στην αγορά από το 1927), Hydrogenics (Βέλγιο), Teledyne Inc (ΗΠΑ), Uralkhimmash (Ρωσία), RusAl (Ρωσία, βελτίωσε σημαντικά την τεχνολογία Soderberg), RutTech (Ρωσία).
- Σε επαφή με 0
- Google+ 0
- Εντάξει 0
- Facebook 0