Δομή και ιδιότητες των ατόμων. Ο επόμενος εκπρόσωπος μετά το άζωτο της κύριας υποομάδας της ομάδας V του Περιοδικού Πίνακα D. I. Mendeleev είναι το μη μεταλλικό στοιχείο φώσφορος R. Τα άτομα φωσφόρου, σε σύγκριση με τα άτομα αζώτου, έχουν μεγαλύτερη ακτίνα, χαμηλότερη τιμή ηλεκτραρνητικότητας και επομένως πιο έντονες αναγωγικές ιδιότητες .
Οι ενώσεις με την κατάσταση οξείδωσης -3 του ατόμου του φωσφόρου είναι λιγότερο συχνές από εκείνες του αζώτου (μόνο στα φωσφίδια - ενώσεις του φωσφόρου με μέταλλα, για παράδειγμα Ca 3 P 2, Na 3 P). Συχνότερα, ο φώσφορος εμφανίζει μια κατάσταση οξείδωσης +5 στις ενώσεις. Και σε συνδυασμό με το υδρογόνο - φωσφίνη PH 3 - ο ομοιοπολικός δεσμός μεταξύ ατόμων διαφορετικών στοιχείων είναι χαμηλής πολικότητας λόγω του γεγονότος ότι οι τιμές ηλεκτραρνητικότητας του φωσφόρου και του υδρογόνου είναι σχεδόν ίδιες.
Ο φώσφορος είναι μια απλή ουσία. Το χημικό στοιχείο φώσφορος σχηματίζει διάφορες αλλοτροπικές τροποποιήσεις. Γνωρίζετε ήδη δύο απλές ουσίες: τον λευκό φώσφορο και τον κόκκινο φώσφορο.
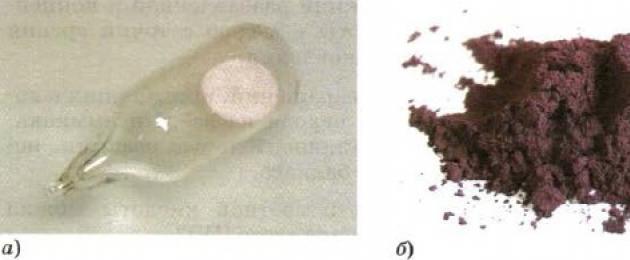
Ο λευκός φώσφορος (Εικ. 137, α) έχει ένα μοριακό κρυσταλλικό πλέγμα που αποτελείται από μόρια P 4. Είναι αδιάλυτο στο νερό, αλλά εύκολα διαλυτό στο δισουλφίδιο του άνθρακα. Στον αέρα, ο λευκός φώσφορος οξειδώνεται εύκολα και σε μορφή σκόνης ακόμη και αναφλέγεται.

Ρύζι. 137.
Αλλοτροπικές τροποποιήσεις του φωσφόρου: α - λευκός φώσφορος; β - κόκκινος φώσφορος
Ο λευκός φώσφορος είναι πολύ δηλητηριώδης. Η ιδιαίτερη ιδιότητά του είναι η ικανότητα να λάμπει στο σκοτάδι λόγω της οξείδωσής του. Αποθηκεύεται κάτω από το νερό.
Ο κόκκινος φώσφορος (Εικ. 137, β) είναι μια σκούρα βυσσινί σκόνη. Δεν διαλύεται ούτε σε νερό ούτε σε δισουλφίδιο του άνθρακα. Στον αέρα οξειδώνεται αργά και δεν αναφλέγεται αυθόρμητα. Μη δηλητηριώδες και δεν λάμπει στο σκοτάδι.
Όταν ο κόκκινος φώσφορος θερμαίνεται σε δοκιμαστικό σωλήνα (Εικ. 138), κλεισμένο με βαμβακερή μπατονέτα, μετατρέπεται σε λευκό φώσφορο. Εάν τραβήξετε το ταμπόν, ο λευκός φώσφορος που εναποτίθεται σε αυτό θα φουντώσει στον αέρα. Αυτό το πείραμα δείχνει την ευφλεκτότητα του λευκού φωσφόρου.

Ρύζι. 138.
Ένα πείραμα που απεικονίζει τη μετάβαση του κόκκινου φωσφόρου σε λευκό
Οι χημικές ιδιότητες του κόκκινου και του λευκού φωσφόρου είναι παρόμοιες, αλλά ο λευκός φώσφορος είναι πιο χημικά ενεργός. Έτσι, και τα δύο, όπως αρμόζει στα μη μέταλλα, αλληλεπιδρούν με μέταλλα, σχηματίζοντας φωσφίδια:

Ο λευκός φώσφορος αναφλέγεται αυθόρμητα στον αέρα, ενώ ο κόκκινος φώσφορος καίγεται όταν αναφλέγεται. Και στις δύο περιπτώσεις, σχηματίζεται οξείδιο του φωσφόρου (V), το οποίο απελευθερώνεται με τη μορφή πυκνού λευκού καπνού:
4P + 5O 2 = 2P 2 O 5.
Εργαστηριακό πείραμα Νο 34
Καύση φωσφόρου στον αέρα και το οξυγόνο
Ο φώσφορος δεν αντιδρά άμεσα με το υδρογόνο, επομένως η φωσφίνη PH 3 μπορεί να ληφθεί μόνο έμμεσα, για παράδειγμα από φωσφίδια:
Ca 3 P 2 + 6HCl = 3CaCl 2 + 2PH 3.
Η φωσφίνη είναι ένα πολύ δηλητηριώδες αέριο με δυσάρεστη οσμή. Εύκολα εύφλεκτο στον αέρα. Αυτή η ιδιότητα της φωσφίνης εξηγεί την εμφάνιση των βάλτων.
Ενώσεις φωσφόρου. Όταν καίγεται ο φώσφορος, όπως ήδη γνωρίζετε, σχηματίζεται οξείδιο του φωσφόρου (V) P 2 O 5 - μια λευκή υγροσκοπική σκόνη. Αυτό είναι ένα τυπικό όξινο οξείδιο, που έχει όλες τις ιδιότητες των όξινων οξειδίων (θυμηθείτε ποια).
Το οξείδιο του φωσφόρου (V) αντιστοιχεί στο φωσφορικό οξύ H 3 PO 4. Είναι μια στερεή διαφανής κρυσταλλική ουσία, εξαιρετικά διαλυτή στο νερό σε οποιαδήποτε αναλογία.
Ως τριβασικό οξύ, το H3PO4 σχηματίζει τρεις σειρές αλάτων:
- μέτρια άλατα ή φωσφορικά άλατα (για παράδειγμα, Ca 3 (PO 4) 2), τα οποία είναι αδιάλυτα στο νερό, εκτός από τα φωσφορικά άλατα των αλκαλιμετάλλων.
- όξινα άλατα - διόξινο φωσφορικά (για παράδειγμα, Ca(H 2 PO 4) 2), τα περισσότερα από τα οποία είναι πολύ διαλυτά στο νερό.
- τα όξινα άλατα είναι υδροφωσφορικά (για παράδειγμα, CaHPO 4), τα οποία είναι ελάχιστα διαλυτά στο νερό (εκτός από φωσφορικά άλατα νατρίου, καλίου και αμμωνίου), δηλ. καταλαμβάνουν μια ενδιάμεση θέση μεταξύ φωσφορικών και διόξινων φωσφορικών σε διαλυτότητα.
Το αντιδραστήριο για διαλυτά φωσφορικά άλατα είναι ένα διάλυμα νιτρικού αργύρου, κατά την αλληλεπίδραση με το οποίο σχηματίζεται ένα κίτρινο ίζημα Ag3P04 (Εικ. 139):

Ρύζι. 139.
Ποιοτική αντίδραση σε φωσφορικό ιόν
Ωστόσο, σε αντίθεση με τα AgBr και AgI, αυτό το ίζημα διαλύεται όταν προστίθεται ένα διάλυμα οξέος (γιατί;).
Εργαστηριακό πείραμα Νο 35
Αναγνώριση φωσφορικών αλάτων
Στη φύση, ο φώσφορος δεν εμφανίζεται σε ελεύθερη μορφή - μόνο με τη μορφή ενώσεων. Οι πιο σημαντικές φυσικές ενώσεις φωσφόρου είναι τα ορυκτά φωσφορίτες και απατίτες. Ο κύριος όγκος τους είναι το φωσφορικό ασβέστιο Ca 3 (PO 4) 2, από το οποίο λαμβάνεται βιομηχανικά ο φώσφορος.
Βιολογική σημασία του φωσφόρου. Ο φώσφορος είναι αναπόσπαστο μέρος των ιστών των ανθρώπινων, ζωικών και φυτικών οργανισμών. Στο ανθρώπινο σώμα, ο περισσότερος φώσφορος συνδέεται με το ασβέστιο. Για την κατασκευή ενός σκελετού, ένα παιδί χρειάζεται ίσες ποσότητες φωσφόρου και ασβεστίου. Εκτός από τα οστά, ο φώσφορος βρίσκεται στο νευρικό ιστό, το αίμα και το γάλα. Στα φυτά, ο φώσφορος είναι μέρος των πρωτεϊνών.
Από τον φώσφορο που εισέρχεται στο ανθρώπινο σώμα με τα τρόφιμα, κυρίως τα αυγά, το κρέας, το γάλα και το ψωμί, δημιουργείται ATP - τριφωσφορικό οξύ αδενοσίνης, που χρησιμεύει ως η κύρια πηγή ενέργειας για τις ενδοκυτταρικές διεργασίες, καθώς και νουκλεϊκά οξέα - DNA και RNA, τα οποία μεταδίδουν τις κληρονομικές ιδιότητες του σώματος . Το ATP καταναλώνεται εντατικά σε όργανα του σώματος που λειτουργούν ενεργά: συκώτι, μύες, εγκέφαλος. Δεν είναι καθόλου τυχαίο ότι ο διάσημος ορυκτολόγος, ένας από τους ιδρυτές της επιστήμης της γεωχημείας, ο ακαδημαϊκός A.E. Fersman αποκάλεσε τον φώσφορο «το στοιχείο της ζωής και της σκέψης».
Όπως αναφέρθηκε, ο φώσφορος υπάρχει στη φύση με τη μορφή ενώσεων που βρίσκονται στο έδαφος (ή διαλυμένες σε φυσικά νερά). Ο φώσφορος εξάγεται από το έδαφος από τα φυτά και τα ζώα τον λαμβάνουν από φυτικές τροφές. Μετά το θάνατο των φυτικών και ζωικών οργανισμών, ο φώσφορος επιστρέφει στο έδαφος. Έτσι συμβαίνει ο κύκλος του φωσφόρου στη φύση (Εικ. 140).

Ρύζι. 140.
Ο κύκλος του φωσφόρου στη φύση
Εφαρμογή του φωσφόρου και των ενώσεων του. Ο κόκκινος φώσφορος χρησιμοποιείται για την παραγωγή σπίρτων και φωσφορικού οξέος, το οποίο, με τη σειρά του, χρησιμοποιείται για την παραγωγή φωσφορικών λιπασμάτων και πρόσθετων ζωοτροφών για τα ζώα. Επιπλέον, ο φώσφορος χρησιμοποιείται για την παραγωγή φυτοφαρμάκων (θυμηθείτε τα κουτάκια του dichlorvos, chlorophos κ.λπ.) (Εικ. 141).

Ρύζι. 141.
Ο φώσφορος και οι ενώσεις του χρησιμοποιούνται για την παραγωγή:
1 - αγώνες? 2 - φωσφορικό οξύ. 3 - λιπάσματα φωσφόρου. 4 - πρόσθετα ζωοτροφών για ζώα. 5 - φυτοφάρμακα
Ανακάλυψη φωσφόρου. Ο φώσφορος ανακαλύφθηκε από τον Γερμανό αλχημιστή G. Brand το 1669, και έλαβε το όνομά του για την ικανότητά του να λάμπει στο σκοτάδι (από το ελληνικό phosphorus - luminiferous).
Νέες λέξεις και έννοιες
- Αλλοτροπία του φωσφόρου: λευκός φώσφορος, κόκκινος φώσφορος.
- Ιδιότητες του φωσφόρου: σχηματισμός φωσφιδίων, φωσφίνη, οξείδιο του φωσφόρου (V).
- Φωσφορικό οξύ και τρεις σειρές αλάτων του: φωσφορικά, όξινα φωσφορικά και διόξινο φωσφορικά.
- Βιολογική σημασία του φωσφόρου (φωσφορικό ασβέστιο, ATP, DNA και RNA).
- Εφαρμογή του φωσφόρου και των ενώσεων του.
Εργασίες για ανεξάρτητη εργασία

Ο φώσφορος και οι ενώσεις του
Εισαγωγή
Κεφάλαιο Ι. Ο φώσφορος ως στοιχείο και ως απλή ουσία
1.1. Ο φώσφορος στη φύση
1.2. Φυσικές ιδιότητες
1.3. Χημικές ιδιότητες
1.4. Παραλαβή
1.5. Εφαρμογή
Κεφάλαιο II. Ενώσεις φωσφόρου
2.1. Οξείδια
2.2. Οξέα και τα άλατά τους
2.3. Φωσφίνη
Κεφάλαιο III. Φωσφορούχα λιπάσματα
συμπέρασμα
Βιβλιογραφία
Εισαγωγή
Ο φώσφορος (lat. Phosphorus) P είναι χημικό στοιχείο της ομάδας V του περιοδικού συστήματος του Mendeleev, ατομικός αριθμός 15, ατομική μάζα 30,973762(4). Ας εξετάσουμε τη δομή του ατόμου του φωσφόρου. Το εξωτερικό επίπεδο ενέργειας του ατόμου του φωσφόρου περιέχει πέντε ηλεκτρόνια. Γραφικά μοιάζει με αυτό:1μικρό 2 2μικρό 2 2Π 6 3μικρό 2 3Π 3 3ρε 0

Το 1699, ο αλχημιστής του Αμβούργου H. Brand, αναζητώντας μια «φιλοσοφική πέτρα» που υποτίθεται ότι μπορούσε να μετατρέψει βασικά μέταλλα σε χρυσό, όταν εξάτμισε τα ούρα με άνθρακα και άμμο, απομόνωσε μια λευκή κηρώδη ουσία που μπορούσε να λάμψει.
Το όνομα «φώσφορος» προέρχεται από τα ελληνικά. “phos” – φως και “phoros” – φορέας. Στη Ρωσία, ο όρος "φώσφορος" εισήχθη το 1746 από τον M.V. Λομονόσοφ.
Οι κύριες ενώσεις φωσφόρου περιλαμβάνουν οξείδια, οξέα και τα άλατά τους (φωσφορικά άλατα, διόξινο φωσφορικά, όξινα φωσφορικά, φωσφίδια, φωσφορικά άλατα).
Πολλές ουσίες που περιέχουν φώσφορο βρίσκονται στα λιπάσματα. Τέτοια λιπάσματα ονομάζονται φωσφορούχα λιπάσματα.
Κεφάλαιο Εγώ Ο φώσφορος ως στοιχείο και ως απλή ουσία
1.1 Ο φώσφορος στη φύση
Ο φώσφορος είναι ένα από τα κοινά στοιχεία. Η συνολική περιεκτικότητα στον φλοιό της γης είναι περίπου 0,08%. Λόγω της εύκολης οξείδωσής του, ο φώσφορος εμφανίζεται στη φύση μόνο με τη μορφή ενώσεων. Τα κύρια ορυκτά του φωσφόρου είναι οι φωσφορίτες και οι απατίτες, από τους οποίους το πιο κοινό είναι ο φθοραπατίτης 3Ca 3 (PO 4) 2 CaF 2. Οι φωσφορίτες είναι ευρέως διαδεδομένοι στα Ουράλια, την περιοχή του Βόλγα, τη Σιβηρία, το Καζακστάν, την Εσθονία και τη Λευκορωσία. Τα μεγαλύτερα κοιτάσματα απατίτη βρίσκονται στη χερσόνησο Κόλα.
Ο φώσφορος είναι απαραίτητο στοιχείο για τους ζωντανούς οργανισμούς. Υπάρχει στα οστά, στους μύες, στον εγκεφαλικό ιστό και στα νεύρα. Τα μόρια ATP κατασκευάζονται από φωσφόρο - τριφωσφορικό οξύ αδενοσίνης (το ATP είναι συλλέκτης και φορέας ενέργειας). Το ενήλικο ανθρώπινο σώμα περιέχει κατά μέσο όρο περίπου 4,5 κιλά φωσφόρου, κυρίως σε συνδυασμό με ασβέστιο.
Ο φώσφορος βρίσκεται επίσης στα φυτά.
Ο φυσικός φώσφορος αποτελείται από ένα μόνο σταθερό ισότοπο 31 R. Σήμερα, είναι γνωστά έξι ραδιενεργά ισότοπα του φωσφόρου.
1.2 Φυσικές ιδιότητες
Ο φώσφορος έχει αρκετές αλλοτροπικές τροποποιήσεις - λευκό, κόκκινο, μαύρο, καφέ, ιώδες φώσφορο κ.λπ. Οι τρεις πρώτες από αυτές είναι οι πιο μελετημένες.
Λευκός φώσφορος- μια άχρωμη κρυσταλλική ουσία με κιτρινωπή απόχρωση που λάμπει στο σκοτάδι. Η πυκνότητά του είναι 1,83 g/cm3. Αδιάλυτο στο νερό, διαλυτό σε διθειάνθρακα. Έχει χαρακτηριστική μυρωδιά σκόρδου. Σημείο τήξεως 44°C, θερμοκρασία αυτοανάφλεξης 40°C. Για την προστασία του λευκού φωσφόρου από την οξείδωση, αποθηκεύεται κάτω από το νερό στο σκοτάδι (στο φως μετατρέπεται σε κόκκινο φώσφορο). Στο κρύο, ο λευκός φώσφορος είναι εύθραυστος· σε θερμοκρασίες πάνω από 15°C γίνεται μαλακός και μπορεί να κοπεί με ένα μαχαίρι.
Τα μόρια λευκού φωσφόρου έχουν ένα κρυσταλλικό πλέγμα, στους κόμβους του οποίου υπάρχουν μόρια P 4, σε σχήμα τετράεδρου.
Κάθε άτομο φωσφόρου συνδέεται με τρεις δεσμούς σ με τα άλλα τρία άτομα.
Ο λευκός φώσφορος είναι δηλητηριώδης και προκαλεί εγκαύματα που δύσκολα επουλώνονται.
Κόκκινος φώσφορος– μια κονιώδης ουσία σκούρου κόκκινου χρώματος, άοσμη, δεν διαλύεται σε νερό και διθειάνθρακα και δεν λάμπει. Θερμοκρασία ανάφλεξης 260°C, πυκνότητα 2,3 g/cm 3 . Ο κόκκινος φώσφορος είναι ένα μείγμα πολλών αλλοτροπικών τροποποιήσεων που διαφέρουν ως προς το χρώμα (από κόκκινο σε βιολετί). Οι ιδιότητες του κόκκινου φωσφόρου εξαρτώνται από τις συνθήκες παραγωγής του. Όχι δηλητηριώδες.
Μαύρος φώσφοροςΜοιάζει με γραφίτη, αισθάνεται λιπαρό στην αφή και έχει ημιαγωγικές ιδιότητες. Πυκνότητα 2,7 g/cm3.
Ο κόκκινος και ο μαύρος φώσφορος έχουν ατομικό κρυσταλλικό πλέγμα.
1.3 Χημικές ιδιότητες
Ο φώσφορος είναι αμέταλλο. Στις ενώσεις, συνήθως εμφανίζει μια κατάσταση οξείδωσης +5, λιγότερο συχνά - +3 και -3 (μόνο στα φωσφίδια).
Οι αντιδράσεις με τον λευκό φώσφορο είναι ευκολότερες από ό,τι με τον κόκκινο φώσφορο.
I. Αλληλεπίδραση με απλές ουσίες.
1. Αλληλεπίδραση με αλογόνα:
2P + 3Cl 2 = 2PCl 3 (χλωριούχος φώσφορος (III)),
PCl 3 + Cl 2 = PCl 5 (χλωριούχος φώσφορος (V).
2. Αλληλεπίδραση με αμέταλλα:
2P + 3S = P 2 S 3 (θειούχος φωσφόρος (III).
3. Αλληλεπίδραση με μέταλλα:
2P + 3Ca = Ca 3 P 2 (φωσφίδιο ασβεστίου).
4. Αλληλεπίδραση με το οξυγόνο:
4P + 5O 2 = 2P 2 O 5 (οξείδιο του φωσφόρου (V), φωσφορικός ανυδρίτης).
II. Αλληλεπίδραση με σύνθετες ουσίες.
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO.
1.4 Απόδειξη
Ο φώσφορος λαμβάνεται από θρυμματισμένους φωσφορίτες και απατίτες, οι τελευταίοι αναμιγνύονται με άνθρακα και άμμο και πυρώνονται σε κλίβανους στους 1500°C:
2Ca 3 (PO 4) 2 + 10C + 6SiO 2
6CaSiO3 + P4 + 10CO.Ο φώσφορος απελευθερώνεται με τη μορφή ατμού, ο οποίος συμπυκνώνεται στον δέκτη κάτω από το νερό, σχηματίζοντας λευκό φώσφορο.
Όταν θερμαίνεται στους 250-300°C χωρίς πρόσβαση αέρα, ο λευκός φώσφορος μετατρέπεται σε κόκκινο.
Ο μαύρος φώσφορος λαμβάνεται με παρατεταμένη θέρμανση του λευκού φωσφόρου σε πολύ υψηλή πίεση (200°C και 1200 MPa).
1.5 Εφαρμογή
Ο κόκκινος φώσφορος χρησιμοποιείται στην κατασκευή σπίρτων (βλ. εικόνα). Είναι μέρος του μείγματος που εφαρμόζεται στην πλαϊνή επιφάνεια του σπιρτόκουτου. Το κύριο συστατικό της κεφαλής του σπίρτου είναι το αλάτι Berthollet KClO 3 . Λόγω της τριβής της κεφαλής του σπίρτου ενάντια στο λιπαντικό, τα σωματίδια φωσφόρου στον αέρα αναφλέγονται. Ως αποτέλεσμα της αντίδρασης οξείδωσης του φωσφόρου, απελευθερώνεται θερμότητα, που οδηγεί στην αποσύνθεση του άλατος Berthollet.
KCl +.
Το οξυγόνο που προκύπτει βοηθά στην ανάφλεξη της κεφαλής του σπίρτου.
Ο φώσφορος χρησιμοποιείται στη μεταλλουργία. Χρησιμοποιείται για την παραγωγή αγωγών και αποτελεί συστατικό ορισμένων μεταλλικών υλικών, όπως οι μπρούτζοι από κασσίτερο.
Ο φώσφορος χρησιμοποιείται επίσης στην παραγωγή φωσφορικού οξέος και φυτοφαρμάκων (διχλωρό, χλωρόφος κ.λπ.).
Ο λευκός φώσφορος χρησιμοποιείται για τη δημιουργία πετασμάτων καπνού, αφού η καύση του παράγει λευκό καπνό.
Κεφάλαιο II . Ενώσεις φωσφόρου
2.1 Οξείδια
Ο φώσφορος σχηματίζει πολλά οξείδια. Τα σημαντικότερα από αυτά είναι το οξείδιο του φωσφόρου (V) P 4 O 10 και το οξείδιο του φωσφόρου (III) P 4 O 6. Συχνά οι τύποι τους γράφονται σε απλοποιημένη μορφή - P 2 O 5 και P 2 O 3. Η δομή αυτών των οξειδίων διατηρεί την τετραεδρική διάταξη των ατόμων φωσφόρου.
Οξείδιο του φωσφόρου(III) Το P 4 O 6 είναι μια κηρώδης κρυσταλλική μάζα που λιώνει στους 22,5 ° C και μετατρέπεται σε άχρωμο υγρό. Δηλητηριώδης.
Όταν διαλύεται σε κρύο νερό σχηματίζει φωσφορικό οξύ:
P 4 O 6 + 6H 2 O = 4H 3 PO 3,
και κατά την αντίδραση με αλκάλια - τα αντίστοιχα άλατα (φωσφίτες).
Ισχυρός αναγωγικός παράγοντας. Όταν αλληλεπιδρά με το οξυγόνο, οξειδώνεται σε P 4 O 10.
Το οξείδιο του φωσφόρου (III) παράγεται από την οξείδωση του λευκού φωσφόρου απουσία οξυγόνου.
Οξείδιο του φωσφόρου(V) P 4 O 10 – λευκή κρυσταλλική σκόνη. Θερμοκρασία εξάχνωσης 36°C. Έχει αρκετές τροποποιήσεις, μία από τις οποίες (η λεγόμενη πτητική) έχει τη σύνθεση P 4 O 10. Το κρυσταλλικό πλέγμα αυτής της τροποποίησης αποτελείται από μόρια P 4 O 10 συνδεδεμένα μεταξύ τους με ασθενείς διαμοριακές δυνάμεις, οι οποίες σπάνε εύκολα όταν θερμαίνονται. Εξ ου και η αστάθεια αυτής της ποικιλίας. Άλλες τροποποιήσεις είναι πολυμερικές. Σχηματίζονται από ατελείωτα στρώματα τετραέδρων PO 4.
Όταν το P 4 O 10 αλληλεπιδρά με το νερό, σχηματίζεται φωσφορικό οξύ:
P 4 O 10 + 6H 2 O = 4H 3 PO 4.
Όντας ένα όξινο οξείδιο, το P 4 O 10 αντιδρά με βασικά οξείδια και υδροξείδια.
Σχηματίζεται κατά την οξείδωση του φωσφόρου σε υψηλή θερμοκρασία σε περίσσεια οξυγόνου (ξηρός αέρας).
Λόγω της εξαιρετικής υγροσκοπικότητας του, το οξείδιο του φωσφόρου (V) χρησιμοποιείται στην εργαστηριακή και βιομηχανική τεχνολογία ως παράγοντας ξήρανσης και αφυδάτωσης. Στην ξηραντική του δράση ξεπερνά όλες τις άλλες ουσίες. Το χημικά δεσμευμένο νερό αφαιρείται από το άνυδρο υπερχλωρικό οξύ για να σχηματίσει τον ανυδρίτη του:
4HClO4 + P4O10 = (HPO3)4 + 2Cl2O7.
2.2 Οξέα και τα άλατά τους
ΕΝΑ) Φωσφορώδες οξύ H3PO3. Το άνυδρο φωσφορώδες οξύ H 3 PO 3 σχηματίζει κρυστάλλους με πυκνότητα 1,65 g/cm 3, που τήκονται στους 74°C.
Δομικός τύπος:
.Όταν το άνυδρο H 3 PO 3 θερμαίνεται, εμφανίζεται μια αντίδραση δυσαναλογίας (αυτο-οξείδωση-αυτοθεραπεία):
4H 3 PO 3 = PH 3 + 3H 3 PO 4.
Άλατα φωσφορικού οξέος – φωσφίτες. Για παράδειγμα, K 3 PO 3 (φωσφορώδες κάλιο) ή Mg 3 (PO 3) 2 (φωσφορώδες μαγνήσιο).
Το φωσφορικό οξύ H 3 PO 3 λαμβάνεται με διάλυση οξειδίου του φωσφόρου (III) σε νερό ή υδρόλυση χλωριούχου φωσφόρου (III) PCl 3:
РCl 3 + 3H 2 O = H 3 PO 3 + 3HCl.
σι) Φωσφορικό οξύ (ορθοφωσφορικό οξύ) H 3 PO 4 .
Το άνυδρο φωσφορικό οξύ εμφανίζεται ως ελαφρά διαφανείς κρύσταλλοι που διαχέονται στον αέρα σε θερμοκρασία δωματίου. Σημείο τήξεως 42,35°C. Το φωσφορικό οξύ σχηματίζει διαλύματα οποιασδήποτε συγκέντρωσης με το νερό.
Δασοστεπικά εδάφη
χαρακτηρίζεται από περιεκτικότητα σε χούμο 1,78-2,46%.Ισχυρά μαύρα εδάφη
περιέχουν 0,81-1,25% χούμο.Συνηθισμένα τσερνοζέμ
περιέχουν 0,90-1,27% χούμο.Ξεπλυμένα τσερνοζέμ
περιέχουν 1,10-1,43% χουμικής ύλης.Τα σκούρα καστανιά εδάφη περιέχουν
σε χουμική ύλη 0,97-1,30%.Ρόλος στο φυτό
Βιοχημικές λειτουργίες
Οι ενώσεις οξειδωμένου φωσφόρου είναι απαραίτητες για όλους τους ζωντανούς οργανισμούς. Κανένα ζωντανό κύτταρο δεν μπορεί να υπάρξει χωρίς αυτά.
Στα φυτά, ο φώσφορος βρίσκεται σε οργανικές και μεταλλικές ενώσεις. Ταυτόχρονα, η περιεκτικότητα σε ορυκτές ενώσεις κυμαίνεται από 5 έως 15%, οργανικές ενώσεις - 85-95%. Οι ορυκτές ενώσεις αντιπροσωπεύονται από άλατα καλίου, ασβεστίου, αμμωνίου και μαγνησίου του ορθοφωσφορικού οξέος. Ο ορυκτός φώσφορος των φυτών είναι μια εφεδρική ουσία, ένα απόθεμα για τη σύνθεση οργανικών ενώσεων που περιέχουν φώσφορο. Αυξάνει τη ρυθμιστική ικανότητα του κυτταρικού χυμού, διατηρεί την κυτταρική σούρωση και άλλες εξίσου σημαντικές διεργασίες.
Οργανικές ενώσεις - νουκλεϊκά οξέα, φωσφορικές αδενοσίνες, φωσφορικά σάκχαρα, νουκλεοπρωτεΐνες και φωσφατοπρωτεΐνες, φωσφατίδια, φυτίνη.
Στην πρώτη θέση σε σημασία για τη ζωή των φυτών βρίσκονται τα νουκλεϊκά οξέα (RNA και DNA) και οι φωσφορικές αδενοσίνες (ATP και ADP). Αυτές οι ενώσεις εμπλέκονται σε πολλές ζωτικές διαδικασίες του φυτικού οργανισμού: σύνθεση πρωτεϊνών, μεταβολισμός ενέργειας, μετάδοση κληρονομικών ιδιοτήτων.
Νουκλεϊκά οξέα
Φωσφορικές αδενοσίνες
Ο ιδιαίτερος ρόλος του φωσφόρου στη ζωή των φυτών είναι η συμμετοχή του στον ενεργειακό μεταβολισμό του φυτικού κυττάρου. Ο κύριος ρόλος σε αυτή τη διαδικασία ανήκει στις φωσφορικές αδενοσίνες. Περιέχουν υπολείμματα φωσφορικού οξέος που συνδέονται με δεσμούς υψηλής ενέργειας. Όταν υδρολύονται, είναι ικανά να απελευθερώνουν σημαντικές ποσότητες ενέργειας.
Αντιπροσωπεύουν ένα είδος συσσωρευτή ενέργειας, που τον τροφοδοτεί όπως απαιτείται για την εκτέλεση όλων των διεργασιών στο κύτταρο.
Υπάρχουν η μονοφωσφορική αδενοσίνη (AMP), η διφωσφορική αδενοσίνη (ADP) και η τριφωσφορική αδενοσίνη (ATP). Το τελευταίο ξεπερνά σημαντικά τα δύο πρώτα σε ενεργειακά αποθέματα και κατέχει πρωταγωνιστικό ρόλο στον ενεργειακό μεταβολισμό. Αποτελείται από αδενίνη (μια βάση πουρίνης) και ένα σάκχαρο (ριβόζη), καθώς και από τρία υπολείμματα φωσφορικού οξέος. Η σύνθεση ATP συμβαίνει στα φυτά κατά την αναπνοή.
Φωσφατίδια
Τα φωσφατίδια, ή φωσφολιπίδια, είναι εστέρες γλυκερόλης, υψηλού μοριακού βάρους λιπαρά οξέα και φωσφορικό οξύ. Αποτελούν μέρος των φωσφολιπιδικών μεμβρανών και ρυθμίζουν τη διαπερατότητα των κυτταρικών οργανιδίων και του πλασμαλήμματος σε διάφορες ουσίες.
Το κυτταρόπλασμα όλων των φυτικών κυττάρων περιέχει λεκιθίνη, μέλος της ομάδας των φωσφατιδίων. Αυτό είναι ένα παράγωγο του διγλυκεριδίου φωσφορικού οξέος, μιας ουσίας που μοιάζει με λίπος που περιέχει 1,37%.
Φωσφορικά άλατα ζάχαρης
Τα φωσφορικά άλατα της ζάχαρης, ή οι εστέρες του φωσφόρου των σακχάρων, υπάρχουν σε όλους τους φυτικούς ιστούς. Περισσότερες από δώδεκα ενώσεις αυτού του τύπου είναι γνωστές. Παίζουν σημαντικό ρόλο στις διαδικασίες της αναπνοής και της φωτοσύνθεσης στα φυτά. Ο σχηματισμός φωσφορικών σακχάρων ονομάζεται φωσφορυλίωση. Η περιεκτικότητα του φυτού σε φωσφορικά σάκχαρα, ανάλογα με την ηλικία και τις διατροφικές συνθήκες, κυμαίνεται από 0,1 έως 1,0% του ξηρού βάρους.
Χωράω
Η φυτίνη είναι ένα άλας ασβεστίου-μαγνήσιου του φωσφορικού οξέος ινοσιτόλης, που περιέχει 27,5%. Κατέχει την πρώτη θέση ως προς την περιεκτικότητα σε φυτά μεταξύ άλλων ενώσεων που περιέχουν φώσφορο. Η φυτίνη υπάρχει σε νεαρά όργανα και ιστούς των φυτών, ιδιαίτερα στους σπόρους, όπου χρησιμεύει ως εφεδρική ουσία και χρησιμοποιείται από τα σπορόφυτα κατά τη διαδικασία βλάστησης.
Κύριες λειτουργίες του φωσφόρου
Ο περισσότερος φώσφορος υπάρχει στα αναπαραγωγικά όργανα και στα νεαρά μέρη των φυτών. Ο φώσφορος είναι υπεύθυνος για την επιτάχυνση του σχηματισμού των ριζικών συστημάτων των φυτών. Η κύρια ποσότητα φωσφόρου καταναλώνεται στις πρώτες φάσεις ανάπτυξης και ανάπτυξης. Οι ενώσεις του φωσφόρου έχουν την ικανότητα να μετακινούνται εύκολα από τους παλιούς ιστούς στους νέους και να επαναχρησιμοποιούνται (ανακυκλώνονται).
Εισαγωγή
Ο φώσφορος (lat. Phosphorus) P είναι χημικό στοιχείο της ομάδας V του περιοδικού συστήματος του Mendeleev, ατομικός αριθμός 15, ατομική μάζα 30,973762 (4). Ας εξετάσουμε τη δομή του ατόμου του φωσφόρου. Το εξωτερικό επίπεδο ενέργειας του ατόμου του φωσφόρου περιέχει πέντε ηλεκτρόνια. Γραφικά μοιάζει με αυτό:
1μικρό 2 2μικρό 2 2Π 6 3μικρό 2 3Π 3 3ρε 0

Το 1699, ο αλχημιστής του Αμβούργου Χ. Ο Brand, αναζητώντας μια «φιλοσοφική πέτρα» που υποτίθεται ότι μπορεί να μετατρέπει βασικά μέταλλα σε χρυσό, όταν εξατμίζει τα ούρα με άνθρακα και άμμο, απομόνωσε μια λευκή κηρώδη ουσία που θα μπορούσε να λάμψει.
Το όνομα «φώσφορος» προέρχεται από τα ελληνικά. "phos" - φως και "phoros" - φορέας. Στη Ρωσία, ο όρος "φώσφορος" εισήχθη το 1746 από τον M.V. Λομονόσοφ.
Οι κύριες ενώσεις φωσφόρου περιλαμβάνουν οξείδια, οξέα και τα άλατά τους (φωσφορικά άλατα, διόξινο φωσφορικά, όξινα φωσφορικά, φωσφίδια, φωσφορικά άλατα).
Πολλές ουσίες που περιέχουν φώσφορο βρίσκονται στα λιπάσματα. Τέτοια λιπάσματα ονομάζονται φωσφορούχα λιπάσματα.
Ο φώσφορος ως στοιχείο και ως απλή ουσία
Ο φώσφορος στη φύση
Ο φώσφορος είναι ένα από τα κοινά στοιχεία. Η συνολική περιεκτικότητα στον φλοιό της γης είναι περίπου 0,08%. Λόγω της εύκολης οξείδωσής του, ο φώσφορος εμφανίζεται στη φύση μόνο με τη μορφή ενώσεων. Τα κύρια ορυκτά του φωσφόρου είναι οι φωσφορίτες και οι απατίτες, από τους οποίους το πιο κοινό είναι ο φθοραπατίτης 3Ca 3 (PO 4) 2 * CaF 2. Οι φωσφορίτες είναι ευρέως διαδεδομένοι στα Ουράλια, την περιοχή του Βόλγα, τη Σιβηρία, το Καζακστάν, την Εσθονία και τη Λευκορωσία. Τα μεγαλύτερα κοιτάσματα απατίτη βρίσκονται στη χερσόνησο Κόλα.
Ο φώσφορος είναι απαραίτητο στοιχείο των ζωντανών οργανισμών. Υπάρχει στα οστά, στους μύες, στον εγκεφαλικό ιστό και στα νεύρα. Τα μόρια ATP κατασκευάζονται από φωσφόρο - τριφωσφορικό οξύ αδενοσίνης (το ATP είναι συλλέκτης και φορέας ενέργειας). Το ενήλικο ανθρώπινο σώμα περιέχει κατά μέσο όρο περίπου 4,5 κιλά φωσφόρου, κυρίως σε συνδυασμό με ασβέστιο.
Ο φώσφορος βρίσκεται επίσης στα φυτά.
Ο φυσικός φώσφορος αποτελείται από ένα μόνο σταθερό ισότοπο 31 R. Σήμερα, είναι γνωστά έξι ραδιενεργά ισότοπα του φωσφόρου.
Φυσικές ιδιότητες
Ο φώσφορος έχει αρκετές αλλοτροπικές τροποποιήσεις - λευκό, κόκκινο, μαύρο, καφέ, ιώδες φώσφορο κ.λπ. Οι τρεις πρώτες από αυτές είναι οι πιο μελετημένες.
Λευκός φώσφορος- μια άχρωμη κρυσταλλική ουσία με κιτρινωπή απόχρωση που λάμπει στο σκοτάδι. Η πυκνότητά του είναι 1,83 g/cm3. Αδιάλυτο στο νερό, διαλυτό σε διθειάνθρακα. Έχει χαρακτηριστική μυρωδιά σκόρδου. Σημείο τήξεως 44°C, θερμοκρασία αυτοανάφλεξης 40°C. Για την προστασία του λευκού φωσφόρου από την οξείδωση, αποθηκεύεται κάτω από το νερό στο σκοτάδι (στο φως μετατρέπεται σε κόκκινο φώσφορο). Στο κρύο, ο λευκός φώσφορος είναι εύθραυστος· σε θερμοκρασίες πάνω από 15°C γίνεται μαλακός και μπορεί να κοπεί με ένα μαχαίρι.
Τα μόρια λευκού φωσφόρου έχουν ένα κρυσταλλικό πλέγμα, στους κόμβους του οποίου υπάρχουν μόρια P 4, σε σχήμα τετράεδρου.
Κάθε άτομο φωσφόρου συνδέεται με τρεις α-δεσμούς με τα άλλα τρία άτομα.
Ο λευκός φώσφορος είναι δηλητηριώδης και προκαλεί εγκαύματα που δύσκολα επουλώνονται.
Κόκκινος φώσφορος- μια κονιώδης ουσία σκούρου κόκκινου χρώματος, άοσμη, αδιάλυτη στο νερό και σε δισουλφίδιο του άνθρακα και δεν λάμπει. Θερμοκρασία ανάφλεξης 260°C, πυκνότητα 2,3 g/cm 3 . Ο κόκκινος φώσφορος είναι ένα μείγμα πολλών αλλοτροπικών τροποποιήσεων που διαφέρουν ως προς το χρώμα (από κόκκινο σε βιολετί). Οι ιδιότητες του κόκκινου φωσφόρου εξαρτώνται από τις συνθήκες παραγωγής του. Όχι δηλητηριώδες.
Μαύρος φώσφοροςΜοιάζει με γραφίτη, αισθάνεται λιπαρό στην αφή και έχει ημιαγωγικές ιδιότητες. Πυκνότητα 2,7 g/cm3.
Ο κόκκινος και ο μαύρος φώσφορος έχουν ατομικό κρυσταλλικό πλέγμα.
Χημικές ιδιότητες
Ο φώσφορος είναι αμέταλλο. Στις ενώσεις συνήθως εμφανίζει κατάσταση οξείδωσης +5, λιγότερο συχνά - +3 και -3 (μόνο στα φωσφίδια).
Οι αντιδράσεις με τον λευκό φώσφορο είναι ευκολότερες από ό,τι με τον κόκκινο φώσφορο.
I. Αλληλεπίδραση με απλές ουσίες.
1. Αλληλεπίδραση με αλογόνα:
2P + 3Cl 2 = 2PCl 3 (χλωριούχος φώσφορος (III)),
PCl 3 + Cl 2 = PCl 5 (χλωριούχος φώσφορος (V).
2. Αλληλεπίδραση με αμέταλλα:
2P + 3S = P 2 S 3 (θειούχος φωσφόρος (III).
3. Αλληλεπίδραση με μέταλλα:
2P + 3Ca = Ca 3 P 2 (φωσφίδιο ασβεστίου).
4. Αλληλεπίδραση με το οξυγόνο:
4P + 5O 2 = 2P 2 O 5 (οξείδιο του φωσφόρου (V), φωσφορικός ανυδρίτης).
II. Αλληλεπίδραση με σύνθετες ουσίες.
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO^.
Παραλαβή
Ο φώσφορος λαμβάνεται από θρυμματισμένους φωσφορίτες και απατίτες, οι τελευταίοι αναμιγνύονται με άνθρακα και άμμο και πυρώνονται σε κλίβανους στους 1500°C:
2Ca 3 (PO 4) 2 + 10C + 6SiO 2 6CaSiO 3 + P 4 ^ + 10CO^.
Ο φώσφορος απελευθερώνεται με τη μορφή ατμού, ο οποίος συμπυκνώνεται στον δέκτη κάτω από το νερό, σχηματίζοντας λευκό φώσφορο.
Όταν θερμαίνεται στους 250-300°C χωρίς πρόσβαση αέρα, ο λευκός φώσφορος μετατρέπεται σε κόκκινο.
Ο μαύρος φώσφορος λαμβάνεται με παρατεταμένη θέρμανση του λευκού φωσφόρου σε πολύ υψηλή πίεση (200°C και 1200 MPa).
Εφαρμογή
Ο κόκκινος φώσφορος χρησιμοποιείται στην κατασκευή σπίρτων (βλ. εικόνα). Είναι μέρος του μείγματος που εφαρμόζεται στην πλαϊνή επιφάνεια του σπιρτόκουτου. Το κύριο συστατικό της κεφαλής του σπίρτου είναι το αλάτι Berthollet KClO 3 . Λόγω της τριβής της κεφαλής του σπίρτου ενάντια στο λιπαντικό, τα σωματίδια φωσφόρου στον αέρα αναφλέγονται. Ως αποτέλεσμα της αντίδρασης οξείδωσης του φωσφόρου, απελευθερώνεται θερμότητα, που οδηγεί στην αποσύνθεση του άλατος Berthollet.

Το οξυγόνο που προκύπτει βοηθά στην ανάφλεξη της κεφαλής του σπίρτου.
Ο φώσφορος χρησιμοποιείται στη μεταλλουργία. Χρησιμοποιείται για την παραγωγή αγωγών και αποτελεί συστατικό ορισμένων μεταλλικών υλικών, όπως οι μπρούτζοι από κασσίτερο.
Ο φώσφορος χρησιμοποιείται επίσης στην παραγωγή φωσφορικού οξέος και φυτοφαρμάκων (διχλωρό, χλωρόφος κ.λπ.).
Ο λευκός φώσφορος χρησιμοποιείται για τη δημιουργία πετασμάτων καπνού, αφού η καύση του παράγει λευκό καπνό.
Ο φώσφορος πιστεύεται ότι είναι ένα ορυκτό που λάμπει στο σκοτάδι που είναι δηλητηριώδες και εύφλεκτο. Αλλά αυτό είναι μόνο ένα μέρος της αλήθειας για αυτό το εκπληκτικό στοιχείο. Ο φώσφορος μπορεί επίσης να είναι διαφορετικός, με ακριβώς αντίθετες ιδιότητες.
Τι είναι ο κόκκινος φώσφορος;
Ο φώσφορος μπορεί να υπάρχει σε διάφορες ποικιλίες (αλλοτροπικές μορφές), οι οποίες διαφέρουν πολύ στις φυσικές και χημικές τους ιδιότητες. Ο λόγος για αυτό είναι οι διαφορές στη δομή. Για παράδειγμα, το κρυσταλλικό πλέγμα του λευκού φωσφόρου είναι μοριακό και το πλέγμα του κόκκινου φωσφόρου είναι ατομικό. Χάρη σε αυτό, αντιδρά αργά με άλλες ουσίες και είναι σταθερό στον αέρα υπό κανονικές συνθήκες (ο λευκός φώσφορος αναφλέγεται στον αέρα). Συνολικά, έχουν βρεθεί περισσότερες από είκοσι τροποποιήσεις στον φώσφορο, τέσσερις από τις οποίες είναι σταθερές (λευκό, κόκκινο, μαύρο και μεταλλικό φώσφορο), οι υπόλοιπες είναι ασταθείς.
Ο κόκκινος φώσφορος είναι μια πολύ ενδιαφέρουσα ουσία, ένα φυσικό ανόργανο πολυμερές με τύπο (P 4)n και μια πολύ σύνθετη δομή πυραμιδικά συνδεδεμένων ατόμων.
Οι ιδιότητες του κόκκινου φωσφόρου εξαρτώνται σε κάποιο βαθμό από τις συνθήκες παραγωγής του. Με την αλλαγή της θερμοκρασίας, του φωτός και των καταλυτών, είναι δυνατό να δημιουργηθούν είδη κόκκινου φωσφόρου με προβλέψιμες ιδιότητες.
Ο ανακαλυπτής του κόκκινου φωσφόρου είναι ο Αυστριακός A. Schrötter, ο οποίος τον απέκτησε θερμαίνοντας μια σφραγισμένη αμπούλα με λευκό φώσφορο και μονοξείδιο του άνθρακα σε θερμοκρασία +500 °C.
Ιδιότητες του κόκκινου φωσφόρου
 Ο κόκκινος φώσφορος παράγεται με παρατεταμένη θέρμανση του λευκού φωσφόρου σε υψηλές θερμοκρασίες (250-300 °C) χωρίς πρόσβαση στον αέρα. Το χρώμα της ουσίας ποικίλλει από μωβ-κόκκινο έως ιώδες.
Ο κόκκινος φώσφορος παράγεται με παρατεταμένη θέρμανση του λευκού φωσφόρου σε υψηλές θερμοκρασίες (250-300 °C) χωρίς πρόσβαση στον αέρα. Το χρώμα της ουσίας ποικίλλει από μωβ-κόκκινο έως ιώδες.
Ο κόκκινος φώσφορος, σε αντίθεση με τον πιο διάσημο «αδελφό» του, τον λευκό φώσφορο, είναι στερεή ουσία, δεν φωτίζει και είναι πρακτικά αδιάλυτος σε τίποτα (ούτε στο νερό, ούτε σε οργανικούς διαλύτες, ούτε σε δισουλφίδιο του άνθρακα). Δεν είναι τοξικό, αναφλέγεται αυθόρμητα στον αέρα μόνο σε θερμοκρασία +240-260 ° C (στην πραγματικότητα, δεν αναφλέγεται ο ίδιος ο κόκκινος φώσφορος, αλλά οι ατμοί του, οι οποίοι, μετά την ψύξη, μετατρέπονται σε λευκό εύφλεκτο φώσφορο) .
Η πυκνότητα του κόκκινου φωσφόρου είναι μεγαλύτερη από αυτή του λευκού φωσφόρου και είναι ίση με 2,0 - 2,4 g/cm3 (ανάλογα με τη συγκεκριμένη τροποποίηση).
Στον αέρα, ο κόκκινος φώσφορος απορροφά την υγρασία και οξειδώνεται, μετατρέποντας σε οξείδιο. συνεχίζοντας να απορροφά την υγρασία, μετατρέπεται σε παχύρρευστο φωσφορικό οξύ («μουλιάζει»). Ενόψει αυτού, το αντιδραστήριο θα πρέπει να σφραγίζεται ερμητικά, αποτρέποντας την πρόσβαση στην υγρασία του αέρα. Όταν θερμαίνεται, ο κόκκινος φώσφορος δεν λιώνει, αλλά εξατμίζεται (εξατμίζεται). Μετά τη συμπύκνωση, ο ατμός της ουσίας μετατρέπεται σε λευκό φώσφορο.
Εφαρμογές κόκκινου φωσφόρου
Ο κόκκινος φώσφορος είναι πρακτικά μη τοξικός και πολύ πιο ασφαλής  σε λειτουργία και αποθήκευση από τον λευκό φώσφορο. Ως εκ τούτου, στη βιομηχανική παραγωγή φωσφιδίων, λιπασμάτων που περιέχουν φωσφόρο και διαφόρων παραγώγων φωσφορικού οξέος, ο κόκκινος φώσφορος χρησιμοποιείται συχνότερα.
σε λειτουργία και αποθήκευση από τον λευκό φώσφορο. Ως εκ τούτου, στη βιομηχανική παραγωγή φωσφιδίων, λιπασμάτων που περιέχουν φωσφόρο και διαφόρων παραγώγων φωσφορικού οξέος, ο κόκκινος φώσφορος χρησιμοποιείται συχνότερα.
Ο ίδιος ο κόκκινος φώσφορος χρησιμοποιείται κυρίως για την κατασκευή σπίρτων. Περιλαμβάνεται στο μείγμα «τρίψιμο», το οποίο εφαρμόζεται στο κουτί. Χρησιμοποιείται επίσης σε λιπαντικά, εμπρηστικές συνθέσεις, καύσιμα και στην παραγωγή λαμπτήρων πυρακτώσεως.
Δεν ξέρετε πού να αγοράσετε κόκκινο φώσφορο;
Μπορείτε να αγοράσετε κόκκινο φώσφορο και διάφορα άλλα χημικά σε ένα από τα μεγαλύτερα καταστήματα εργαστηριακού εξοπλισμού, την Prime Chemicals Group. Έχουμε προσιτές τιμές και βολική παράδοση σε όλη τη Μόσχα και την περιοχή, και καταρτισμένοι διαχειριστές θα σας βοηθήσουν να κάνετε μια επιλογή.
- Σε επαφή με 0
- Google+ 0
- Εντάξει 0
- Facebook 0